熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Exogenous Oxygen Is Required for Prostanoid Induction Under Brain Ischemia as Evidence for a Novel Regulatory Mechanism
腦缺血下前列腺素誘導需要外源性氧,作為新型調節機制的證據
期刊:Journal of Lipid Research (2023) 64(11) 100452
摘要核心內容
本研究顛覆了傳統理論(腦缺血通過磷脂酶激活釋放花生四烯酸(20:4n6)促進前列腺素(PG)合成),首次提出氧氣可用性是PG合成的關鍵限速因素。通過實時監測小鼠腦缺血后皮質氧分壓(O?)、游離20:4n6及PG水平,發現:
O?半衰期極短:缺血后腦組織O?濃度在12秒內降至不可檢測水平(T?/?=5.32±0.45 s);
PG未原位升高:缺血30秒至10分鐘時,PG水平無顯著變化(微波固定組);
暴露于大氣氧觸發PG合成:非微波固定的缺血腦組織在取樣時接觸大氣氧后PG升高30倍;
缺氧環境抑制PG合成:在無氧條件下取樣時PG不升高。
結論:傳統報道的“缺血誘導PG”實為取樣時暴露于外源性氧氣的假象,O?是PG合成的必需底物。
研究目的
驗證新假說:探究腦缺血時O?耗竭是否抑制PG合成(傳統理論忽略O?對環氧合酶COX活性的影響);
區分機制貢獻:厘清20:4n6釋放與O?可用性在PG合成中的相對作用;
方法學革新:通過微波固定(MW)技術原位滅活酶活性,避免取樣時O?暴露的干擾。
研究思路
實時監測O?動力學:將Unisense OX-10微電極植入小鼠皮質,記錄缺血后O?衰減曲線;
對比酶活性狀態:
MW組:缺血后立即微波固定,滅活酶活性,反映原位代謝狀態;
非MW組:缺血后常規取樣,酶活性暴露于大氣氧;
控制氧氣變量:
缺氧操作:在無氧手套箱中取樣;
氧氣暴露:缺氧取樣后組織暴露于大氣氧;
多時間點分析:檢測缺血后0.5、2、10分鐘的游離20:4n6及PG(PGE?、PGD?、TXB?等)。
關鍵數據及其意義
O?快速耗竭(圖1)
數據:缺血后皮質O?濃度從54.6±3.2μM降至<10 nM(12秒內),T?/?=5.32±0.45秒。
意義:O?早于20:4n6釋放前耗盡,且低于COX的Km(O?)(10–100μM),直接抑制PG合成。
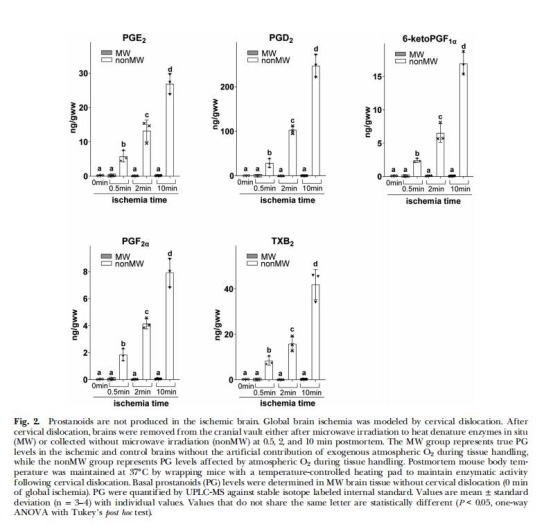
PG未原位升高(圖2)
數據:MW組(酶滅活)中,缺血0.5–10分鐘PG無變化;非MW組(暴露大氣氧)PG升高23–109倍。
意義:傳統報道的“缺血誘導PG”實為取樣時O?暴露的假象。
20:4n6釋放與PG脫鉤(圖3)

數據:缺血2–10分鐘,游離20:4n6升高50–100倍(MW與非MW組無差異),但僅非MW組PG同步升高。
意義:20:4n6釋放是必要非充分條件,PG合成依賴O?供應。
缺氧環境抑制PG合成(圖4)
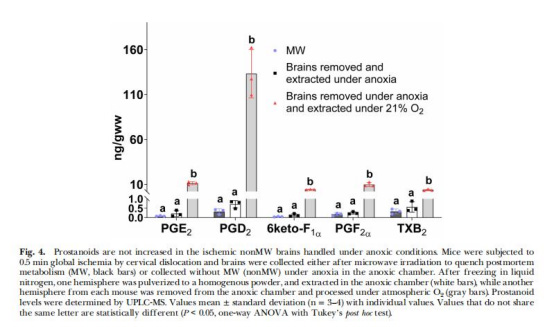
數據:缺氧條件下取樣的非MW腦組織PG無變化;暴露大氣氧后PG顯著升高。
意義:直接證明O?是PG合成的觸發因素,排除組織損傷干擾。
結論
顛覆傳統認知:腦缺血本身不誘導PG合成,O?可用性是PG合成的關鍵限速因素;
方法學啟示:常規取樣(接觸大氣氧)導致假陽性結果,需結合微波固定技術;
生理意義:O?濃度可能通過調節COX活性參與腦血流/代謝的快速適應(如低氧血管舒張)。
丹麥Unisense微電極的應用意義
技術原理與優勢
傳感器設計:Unisense OX-10微電極(10μm針尖)基于電化學還原反應(O?+4H?+4e?→2H?O),實時檢測組織O?分壓(μM級精度);
原位動態監測:
直接植入皮質(坐標:-1 mm DV,2 mm ML,-2 mm AP),避免血流干擾;
高時間分辨率(秒級),捕捉O?的指數衰減(圖1A);

關鍵研究發現
O?耗竭速度量化:
首次精確測定腦缺血后O?T?/?=5.32秒(圖1),早于20:4n6釋放(>30秒);
揭示O?耗竭先于能量衰竭/鈣超載,為“O?限制PG合成”提供時間窗證據。
Km(O?)驗證:
實測O?濃度在12秒內降至<10 nM,遠低于COX的Km(O?)(5–16μM),直接抑制酶活性;
解釋為何缺血時20:4n6堆積但PG不合成(缺O?底物)。
研究意義拓展
解決爭議:澄清既往研究中PG“缺血誘導”的取樣假象(如顱骨切開暴露于O?);
新調控機制:提出組織O?濃度為PG合成的獨立調控因子(超越傳統20:4n6釋放理論);
轉化價值:
為缺血性腦病治療提供新靶點(如調控局部O?輸送);
微電極技術可拓展至其他缺氧相關病理研究(如卒中、腫瘤微環境)。
技術局限性
空間分辨率限制:單點監測可能忽略腦區異質性(如皮質vs.腦干O?梯度);
麻醉干擾:實驗需用氯胺酮/甲苯噻嗪麻醉,可能輕微影響基礎O?水平(但缺血動力學無差異)。
總結
Unisense微電極是本研究的核心技術支柱,其高時空分辨率與低侵入性特性,為揭示“O?依賴性PG合成”機制提供了不可替代的直接證據。該技術不僅革新了對缺血病理的認知,也為靶向O?遞送的干預策略奠定基礎。
<strike id="yiuck"></strike>
<strike id="yiuck"></strike>