熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Soil bacteria protect fungi from phenazines by acting as toxin sponges
土壤細菌通過充當毒素海綿來保護真菌免受吩嗪的侵害
來源:Dahlstrom & Newman, 2022, Current Biology 32, 275–288
摘要核心內容
本研究揭示了土壤細菌Paraburkholderia edwinii通過充當“毒素海綿”保護共生真菌(如Aspergillus)免受吩嗪類抗生素(如吩嗪-1-羧酸,PCA)毒害的機制。核心發現包括:
物理共生對的形成:從土壤中分離出真菌-細菌共生對,真菌在缺乏細菌時對PCA敏感(抑制濃度>300 μM),而細菌存在時真菌生長恢復(圖1B)。

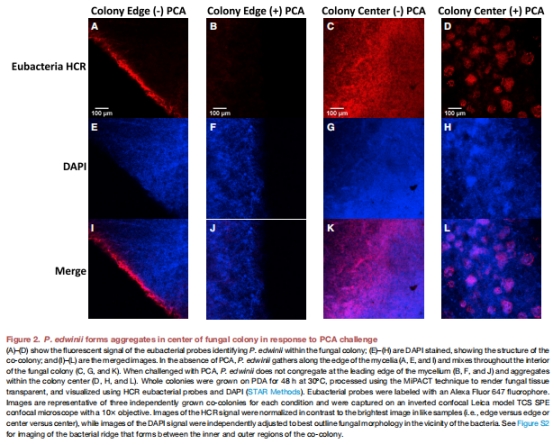
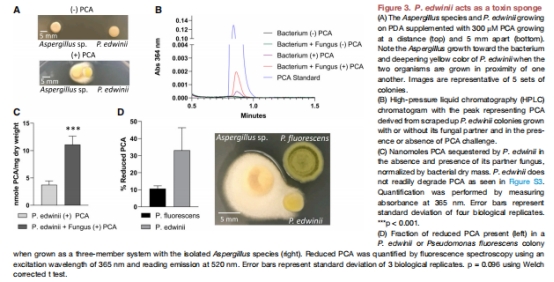
毒素海綿機制:P. edwinii通過形態重塑(形成聚集體)和PCA螯合(圖2),將PCA還原為無毒態(圖3D),降低環境中PCA濃度(圖3C)。
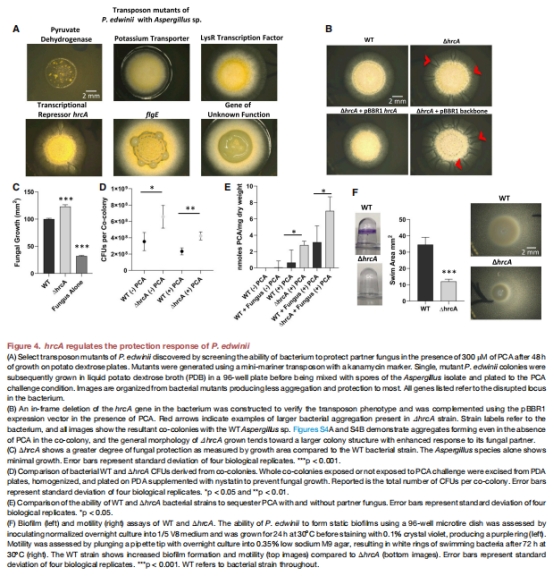
調控機制:真菌分泌有機酸酸化微環境(pH↓2-3單位),激活細菌應激響應蛋白HrcA(圖4),觸發保護程序(圖4B)。
廣譜保護性:該機制適用于多種真菌(包括病原真菌Aspergillus fumigatus)和細菌(如Paraburkholderia unamae)(圖6)。

研究目的
解析生態悖論:闡明敏感真菌如何在含吩嗪的環境中與產吩嗪細菌共存。
揭示保護機制:探究細菌保護真菌的分子與生化基礎。
評估普適性:驗證該機制在不同微生物組合中的適用性。
研究思路與技術路線
采用 土壤采樣→共生對分離→機制解析→應用驗證 策略:
樣品處理與分離:
采集校園土壤(圖1A),超聲洗滌分離緊密共生微生物對。
通過PCA(300 μM)脅迫篩選保護性細菌(如P. edwinii)及其共生真菌(如Aspergillussp.)。
保護機制驗證:
形態觀察:PCA脅迫下細菌形成聚集體(圖2),螯合PCA(圖3B-C)。
代謝分析:LC-MS證實PCA螯合(圖3B),還原態PCA占比↑33%(圖3D)。
基因調控:轉座子篩選鎖定關鍵基因hrcA(圖4A),△hrcA突變體保護能力↑2倍(圖4B-D)。
環境因子調控:
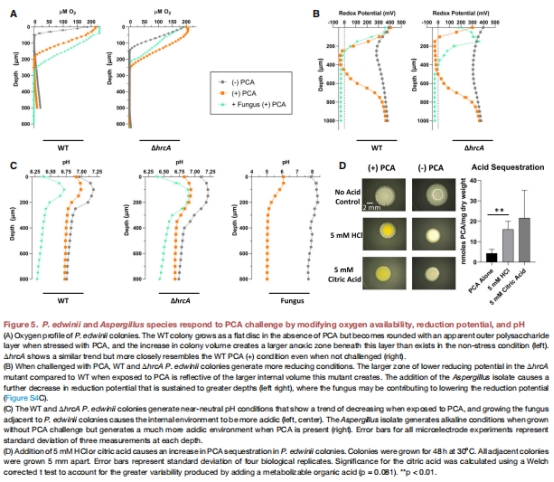
pH作用:真菌酸化環境(pH↓至4.0)激活細菌應激響應(圖5C-D)。
氧還原電位:Unisense電極證實聚集體內部為強還原環境(ORP=-30 mV)(圖5B)。
普適性驗證:測試7種真菌(含人類病原體)與4種Paraburkholderia的組合(圖6)。
關鍵數據及研究意義
1. PCA螯合與還原(圖3)
數據:
P. edwinii螯合PCA量:與真菌共生時↑1.8倍(圖3C)。
聚集體內還原態PCA占比:33%(細菌單培養)→40%(與真菌共生)(圖3D)。
意義:首次量化細菌“毒素海綿”能力,揭示螯合-還原雙途徑解毒機制。
2. 微環境酸化觸發保護(圖5)
數據:
真菌單獨暴露PCA時,pH↓2-3單位(圖5C)。
人工酸化(HCl/檸檬酸)模擬真菌效應,使PCA螯合量↑4倍(圖5D)。
意義:確立pH為關鍵調控信號,解釋細菌-真菌跨界對話的化學基礎。
3. HrcA的核心調控作用(圖4)
數據:
△hrcA突變體:細菌聚集體增大50%,真菌生長面積↑80%(圖4B-C)。
△hrcA的PCA螯合量↑2.3倍(圖4E)。
意義:鎖定HrcA為應激響應樞紐,為工程菌設計提供靶點。
4. 跨物種保護普適性(圖6)
數據:
P. edwinii保護Aspergillus fumigatus(人類病原體)和Fusarium(植物病原體)免受PCA抑制(圖6E, G)。
保護效率:Penicillium glabrum↑90%,但P. echinulatum無響應(圖6F-G)。
意義:機制適用于農業(根際益生)和醫療(病原菌互作調控)場景。
Unisense電極數據的專項解讀
技術原理與部署
型號與功能:丹麥Unisense氧化還原電位(ORP)微電極(25 μm尖端),實時監測細菌聚集體內部電子傳遞狀態(圖5B)。
部署場景:
測量PCA脅迫下細菌聚集體(50-100 μm)的縱向ORP梯度(0-660 μm深度)。
關鍵發現與機制解析
強還原環境驗證(圖5B):
聚集體核心ORP低至-30 mV(對照:>280 mV),證實為強還原微環境。
意義:直接解釋PCA被還原解毒的原因(還原態PCA失去毒性)。
氧分區與解毒關聯(圖5A):
電極顯示聚集體內部缺氧(深度>280 μm時DO=0),與PCA還原需求匹配。
意義:缺氧環境抑制PCA再氧化,維持長效解毒。
突變體增強還原(圖5B):
△hrcA聚集體ORP更低(-50 mV),還原體積↑30%,支持HrcA抑制保護程序。
研究意義
方法學創新:
Unisense電極實現微米級原位ORP監測,突破傳統批量測量的空間局限。
機制深度解析:
量化“細菌聚集體=還原微反應器”理論,為生物解毒提供物理化學證據。
應用指導:
電極數據指導優化聚集體尺寸(>50 μm),為合成生物學設計提供參數。
核心結論
新型共生機制:P. edwinii作為“毒素海綿”,通過螯合-還原雙路徑解除PCA對真菌的毒害。
跨界對話樞紐:真菌酸化環境觸發細菌HrcA應激響應,激活保護程序。
生態與工程意義:該機制廣泛存在于根際與感染微環境,為抗病原真菌療法提供新思路。
應用價值
農業領域:利用Paraburkholderia保護益生真菌(如菌根真菌),增強作物抗逆性。
生物防治:設計“細菌保鏢”工程菌,阻斷植物病原真菌(如Fusarium)侵染。
醫學啟示:解析肺部(如囊性纖維化患者)真菌-細菌互作,為混合感染提供干預靶點。
總結:本研究通過Unisense電極等多尺度技術,揭示細菌以“毒素海綿”方式保護真菌的跨界互作機制,為微生物群落調控提供了新范式。
<strike id="yiuck"></strike>
<strike id="yiuck"></strike>