熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Effects of Live Combined Bacillus subtilis and Enterococcus faecium on Gut Microbiota Composition in C57BL/6 Mice and in Humans
活的枯草芽孢桿菌和屎腸球菌對 C57BL6 小鼠和人類腸道菌群組成的影響
來源:Frontiers in Cellular and Infection Microbiology February 2022 | Volume 12 | Article 821662
一、摘要概述
本研究探索了枯草芽孢桿菌R-179(B. subtilis R-179)與屎腸球菌R-026(E. faecium R-026)聯合制劑(LCBE)對腸道菌群的調節作用及其健康效應:
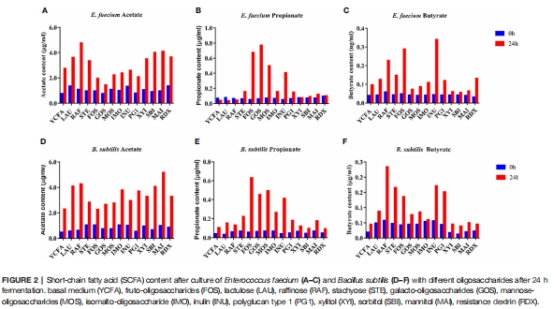
核心發現:LCBE通過降低腸道氧化還原電位(Unisense電極測量)、促進短鏈脂肪酸(SCFA)生成(圖2),顯著改善高脂飲食小鼠的血脂代謝(總膽固醇降低,圖3),并調節腸道菌群組成(厚壁菌門/擬桿菌門比值降低,阿克曼菌屬和雙歧桿菌屬豐度增加,圖4)。


作用機制:
LCBE與低聚糖(如GOS)協同促進厭氧益生菌(如雙歧桿菌、丁酸梭菌)增殖(表1)。

通過降低腸道氧化環境(表2),創造利于有益菌生長的微環境。

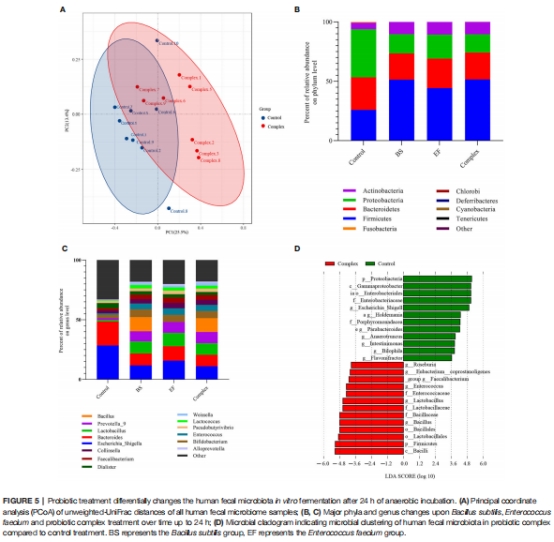
跨物種驗證:人體糞便體外發酵實驗證實LCBE增加乳桿菌和雙歧桿菌豐度,降低大腸桿菌-志賀菌屬(圖5)。
二、研究目的
解決兩大科學問題:
機制不明確:LCBE(商品化益生菌組合)對腸道菌群的具體調節機制尚未系統研究。
應用場景拓展:探究LCBE能否通過調節菌群改善高脂飲食誘導的代謝紊亂(如高膽固醇血癥)。
三、研究思路
采用體外-體內-人體驗證三級研究框架:
體外實驗:
測試LCBE在12種寡糖中的生長曲線(圖1)及SCFA產量(圖2)。

與厭氧菌(長雙歧桿菌、丁酸梭菌)共培養,評估共生關系(表1)。
Unisense電極測量氧化還原電位(表2),分析腸道微環境變化。
小鼠模型:
高脂飲食誘導高血脂C57BL/6小鼠,給予LCBE±低聚半乳糖(GOS)干預8周。
檢測血脂(圖3)、腸道菌群(16S rRNA測序,圖4)。
人體驗證:
10名健康人糞便體外發酵,分析LCBE對菌群組成的影響(圖5)。
四、測量的數據及其研究意義
1. 菌株生長與共生關系(體外)
數據來源:圖1(生長曲線)、表1(共培養活菌計數)。
關鍵結果:
GOS和FOS顯著促進E. faecium和B. subtilis生長(圖1A-B)。
LCBE與厭氧菌共培養時,丁酸梭菌活菌數提升4倍(表1)。
研究意義:證實LCBE與腸道厭氧益生菌存在共生關系,為聯合應用提供依據。
2. 短鏈脂肪酸(SCFA)生成
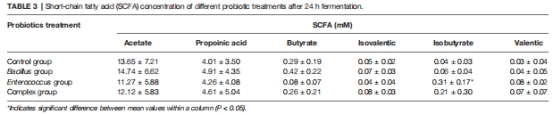
數據來源:圖2(SCFA產量)、表3(人體發酵SCFA)。
關鍵結果:
LCBE+GOS組丁酸產量最高(圖2F),人體發酵中LCBE提升異丁酸濃度(表3)。
研究意義:SCFA(尤其丁酸)是腸道屏障功能關鍵能源,直接關聯代謝健康。
3. 氧化還原電位變化(核心機制)
數據來源:表2(Unisense電極數據)。
關鍵結果:
LCBE共培養組氧化還原電位降至353.5 mV(vs. 空白組550.5 mV)。
研究意義:首次量化LCBE對腸道氧化微環境的調節能力,為益生菌改善缺氧環境提供直接證據。
4. 動物模型效果
數據來源:圖3(血脂)、圖4(菌群)。
關鍵結果:
LCBE+GOS顯著降低小鼠總膽固醇(圖3B)。
厚壁菌門/擬桿菌門比值從1.8降至0.3,阿克曼菌屬豐度增加(圖4A)。
研究意義:證實LCBE通過菌群調節改善高脂飲食誘導的代謝紊亂。
5. 人體菌群調節
數據來源:圖5(菌群組成)。
關鍵結果:
LCBE處理組乳桿菌和雙歧桿菌增加,大腸桿菌-志賀菌屬減少(圖5B-C)。
研究意義:跨物種驗證LCBE的益生作用,支持其臨床轉化潛力。
五、結論
機制層面:
LCBE通過降低腸道氧化還原電位(表2),創造厭氧環境促進有益菌(雙歧桿菌、阿克曼菌)定植。
與GOS協同提升SCFA(尤其丁酸)產量,改善腸道屏障功能。
健康效應:
顯著降低高脂飲食小鼠血膽固醇(圖3),調節菌群平衡(F/B比值↓)。
人體腸道模型中抑制致病菌(大腸桿菌-志賀菌屬),增強益生菌。
應用價值:LCBE可作為代謝綜合征(如高血脂)的輔助干預手段。
六、丹麥Unisense電極數據的詳細解讀
1. 測量方法與數據位置
技術原理:使用Unisense Ag/AgCl參比電極(方法2.5),在厭氧條件下測量發酵液氧化還原電位(Eh),精度達±1 mV。
檢測場景:
體外發酵系統:24小時厭氧培養后測量上清液Eh(表2)。
校準標準:以飽和醌氫醌緩沖液(pH 4/7)為基準,數據換算至標準氫電極。
2. 關鍵結果與機制關聯
結果:
LCBE共培養組Eh=353.5 mV,顯著低于單菌組(B. subtilis: 439.7 mV; E. faecium: 430.7 mV)。
機制關聯:
低Eh值(還原環境) 直接促進厭氧益生菌(如雙歧桿菌)生長,抑制好氧致病菌。
解釋LCBE提升丁酸梭菌活性的原因(表1):丁酸梭菌為嚴格厭氧菌,依賴低Eh環境。
3. 研究意義
技術優勢:
實時動態監測:避免傳統培養法的延時誤差,精準反映微環境變化。
微創原位檢測:電極可直接插入發酵體系,模擬腸道真實環境。
科學價值:
首次揭示LCBE通過耗氧降低Eh的機制:B. subtilis消耗游離氧,E. faecium代謝產還原物質。
為益生菌制劑優化提供關鍵參數(如Eh<-300 mV為理想厭氧閾值)。
臨床啟示:腸道Eh可作為益生菌療效的生物標志物,指導個體化干預。
總結:本研究通過Unisense電極等多項技術,闡明LCBE通過調節氧化還原電位重塑腸道微環境,進而促進有益菌增殖、改善代謝健康的作用機制。其跨物種驗證(小鼠-人體)為LCBE的臨床應用提供堅實證據。
<strike id="yiuck"></strike>
<strike id="yiuck"></strike>