熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Malaria parasite infection compromises colonization resistance to an enteric pathogen by reducing gastric acidity
瘧原蟲感染通過降低胃酸損害對腸道病原體的定植抗性
來源:Science Advances 7 eabd6232; 2021
《科學進展》第7卷,文章編號eabd6232;2021年
摘要內容:
研究發現瘧原蟲(Plasmodium yoelii)感染通過降低胃酸分泌削弱宿主對腸道病原體(鼠傷寒沙門氏菌,Salmonella Typhimurium)的定植抗性。感染導致小鼠胃pH值升高(平均pH=4.02 vs 對照組2.46),胃酸分泌減少。這種胃酸缺乏顯著提高沙門氏菌在胃部的存活率,增加其在腸道定植能力。機制上,瘧疾感染上調胃組織TNF-α表達,抑制促胃酸激素(降鈣素)并激活抑制性激素(生長抑素)。通過組胺H2受體激動劑(dimaprit)刺激胃酸分泌可恢復定植抗性,而阻斷TNF-α信號則預防胃酸減少和沙門氏菌過度定植。
研究目的:
闡明瘧疾感染如何削弱宿主對腸道病原體的定植抗性,重點關注胃酸屏障的作用機制。
研究思路:
1. 建立瘧疾-沙門氏菌共感染模型:小鼠感染P. yoelii后6天(寄生蟲血癥高峰期)口服沙門氏菌(毒力缺陷株invA spiB)。
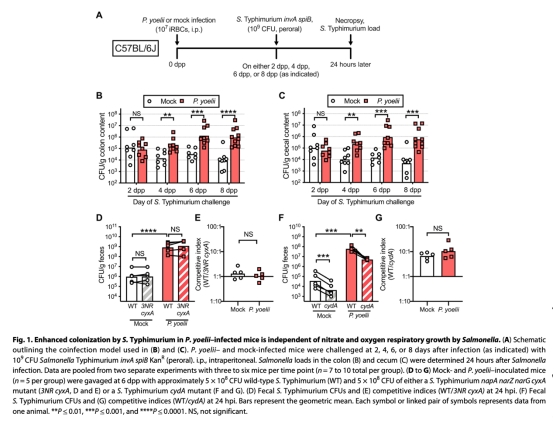
2. 排除下腸道機制:驗證硝酸鹽呼吸(圖1D-E)和氧氣依賴生長(圖1F-G)不參與定植增加。
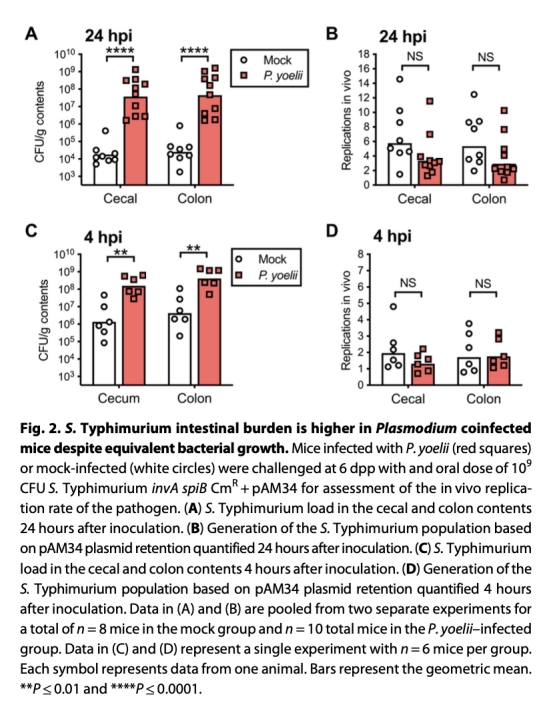
3. 聚焦上消化道屏障:檢測胃pH值(圖3B)、沙門氏菌胃存活率(圖3A)及早期定植動態(圖2C-D)。
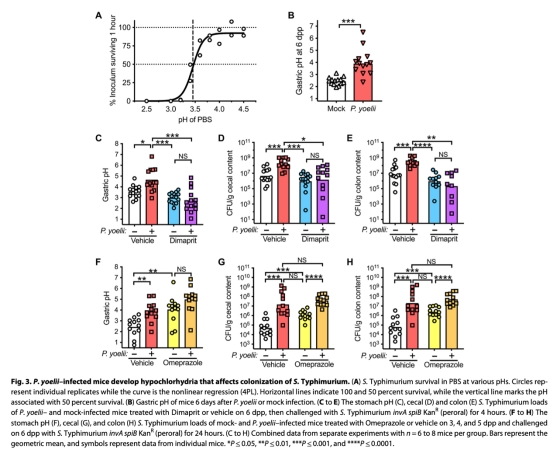
4. 干預驗證:使用胃酸激動劑(dimaprit,圖3C-E)和抑制劑(omeprazole,圖3F-H)操控胃酸分泌;阻斷TNF-α信號(圖5B-C)。
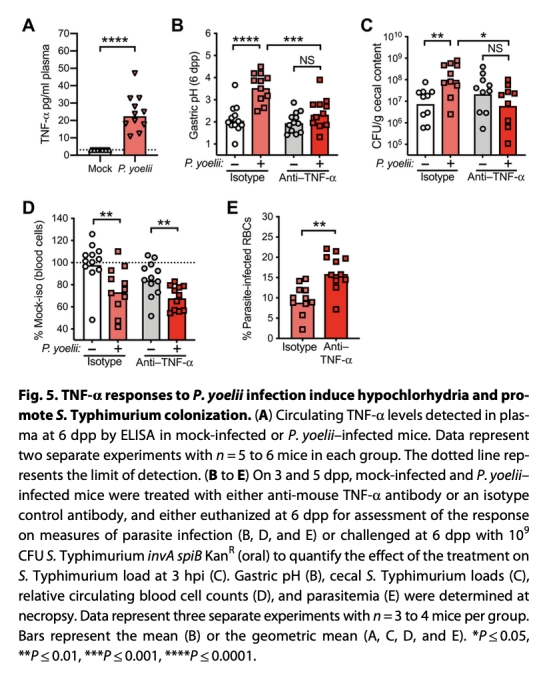
5. 機制探索:分析胃酸調控基因(圖4A-D)及TNF-α作用(圖5A, F)。

測量數據、來源及研究意義:
1. 沙門氏菌腸道定植(圖1B-C, 圖3D-E)
? 數據:瘧疾感染組盲腸/結腸沙門氏菌負荷增加10-100倍(圖1B-C);胃酸激動劑處理恢復定植抗性(圖3D-E)。
? 意義:證明瘧疾感染獨立于病原體毒力,通過胃酸屏障崩潰促進腸道定植。
2. 胃pH值與胃酸調控(圖3B, 圖4A-D)
? 數據:感染組胃pH=4.02±1.07 vs 對照組2.46±0.32(圖3B);降鈣素表達↓2-4倍,生長抑素表達↑2倍(圖4A-B)。
? 意義:揭示瘧疾通過激素失衡抑制胃酸分泌,提供機制證據。
3. TNF-α介導的信號通路(圖4F, 圖5)
? 數據:感染組胃組織TNF-α mRNA↑(圖4F);血漿TNF-α↑(圖5A);TNF-α抗體阻斷預防胃酸升高(圖5B)和沙門氏菌定植增加(圖5C)。
? 意義:確立TNF-α為上游調控因子,連接免疫反應與胃酸分泌障礙。
4. 細菌生長動力學(圖2A-D)
? 數據:感染組4小時腸道菌量已顯著升高(圖2C),但復制速率無差異(圖2B,D)。
? 意義:排除細菌增殖加速因素,指向早期生存優勢(胃酸屏障失效)。
結論:
1. 瘧疾感染通過TNF-α信號介導胃酸缺乏,削弱上消化道抗菌屏障。
2. 胃酸升高(pH>4)顯著提高沙門氏菌胃存活率,驅動腸道定植增加。
3. 該機制解釋瘧疾患者易發非傷寒沙門氏菌血癥的臨床現象,為干預提供靶點(如胃酸調節)。
丹麥Unisense電極測量數據的研究意義:
使用Unisense微電極(PH-N探頭)直接測量活體胃腔pH值(圖3B),其核心價值在于:
1. 原位實時監測:避免離體組織pH偏移,精準反映功能狀態(對照組pH=2.46符合生理酸性)。
2. 微創定量:微電極插入胃腔實時讀數,定量瘧疾感染組pH升高1.56單位(ΔpH≈1.56),直接關聯胃酸減少與定植抗性喪失。
3. 機制驗證:結合干預實驗(圖3C, F),證明胃酸激動劑使感染組pH降至2.5(恢復抗菌功能),而質子泵抑制劑模擬瘧疾效應(pH升至4.0)。
4. 技術優勢:高時空分辨率(毫伏級信號轉化pH值),適用于活體器官微環境動態監測。
<strike id="yiuck"></strike>
<strike id="yiuck"></strike>