熱線:021-66110810,66110819
手機(jī):13564362870


熱線:021-66110810,66110819
手機(jī):13564362870
Light-controlled oxygen production and collection for sustainable photodynamic therapy in tumor hypoxia
用于腫瘤缺氧持續(xù)光動力治療的光控制氧生產(chǎn)和收集
來源:Biomaterials 269 (2021) 120621
1. 摘要核心內(nèi)容
本研究提出一種光控可持續(xù)光動力療法(PDT),通過光合微生物(小球藻)產(chǎn)氧和全氟化碳(PFC)富集氧的策略解決腫瘤缺氧導(dǎo)致的PDT耐藥問題。核心發(fā)現(xiàn):
雙功能氧管理:
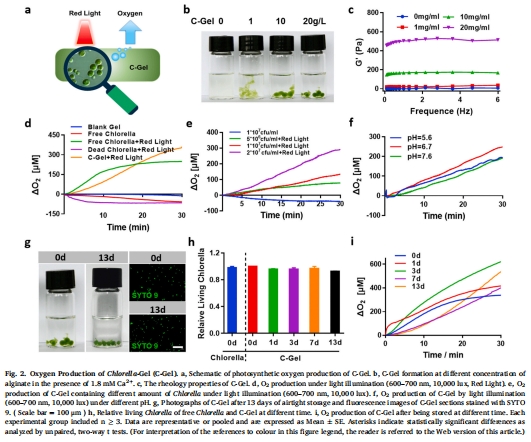
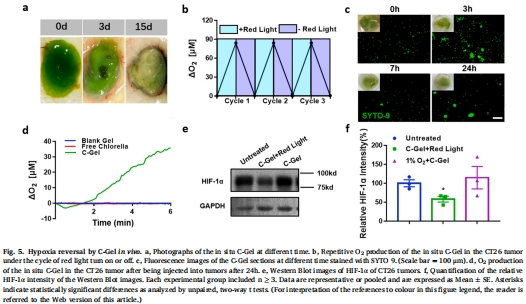
小球藻凝膠(C-Gel)在紅光(600–700 nm)照射下持續(xù)產(chǎn)氧,逆轉(zhuǎn)腫瘤缺氧(圖2d,e);
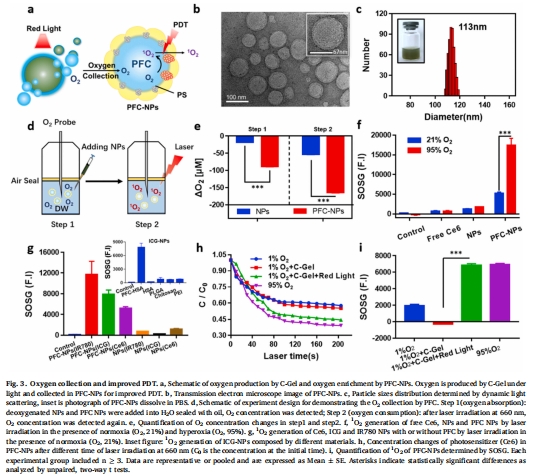
PFC納米顆粒(PFC-NPs)作為氧收集器,將氧富集于光敏劑周圍,提升單線態(tài)氧(1O?)產(chǎn)量(圖3f)。
協(xié)同療效:
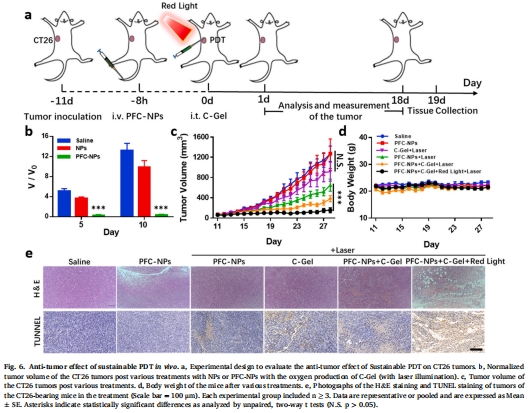
在CT26結(jié)腸癌模型中,PDT抑瘤率達(dá)90%(圖6c),30%實(shí)現(xiàn)完全消退(圖6e);
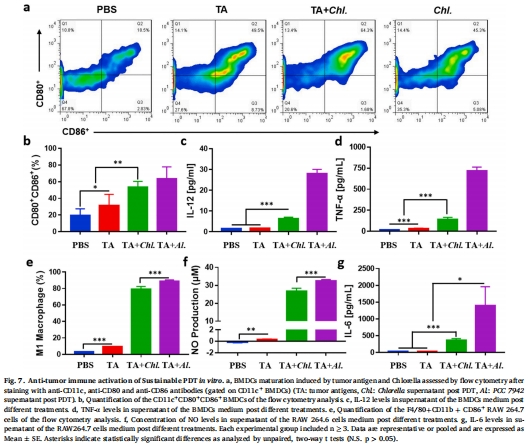
小球藻經(jīng)PDT處理后釋放免疫刺激分子(如β-葡聚糖),增強(qiáng)樹突細(xì)胞(DC)活化(圖7)。
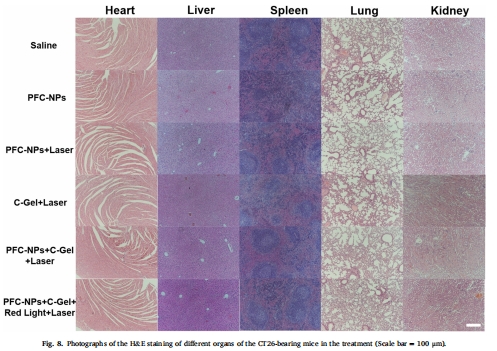
安全性:治療組小鼠體重穩(wěn)定,器官無病理損傷(圖6d, 圖8)。
2. 研究目的
克服腫瘤缺氧對PDT療效的限制;
開發(fā)光控的可持續(xù)氧供給系統(tǒng)(小球藻光合作用 + PFC氧富集);
驗(yàn)證協(xié)同策略對PDT療效的增強(qiáng)作用;
探索小球藻的免疫調(diào)節(jié)功能。
3. 研究思路
材料設(shè)計(jì) → 體外驗(yàn)證 → 體內(nèi)療效 → 機(jī)制拓展:
材料構(gòu)建:
C-Gel:海藻酸鈉包裹小球藻形成凝膠(圖2a),保護(hù)小球藻活性并提升產(chǎn)氧效率(圖2d,i);
PFC-NPs:全氟三丁胺(PFTBA)負(fù)載光敏劑Ce6,形成核殼結(jié)構(gòu)納米顆粒(圖3b-c)。
體外機(jī)制:
缺氧逆轉(zhuǎn):C-Gel光照后降低HIF-1α表達(dá)(圖4b-c);
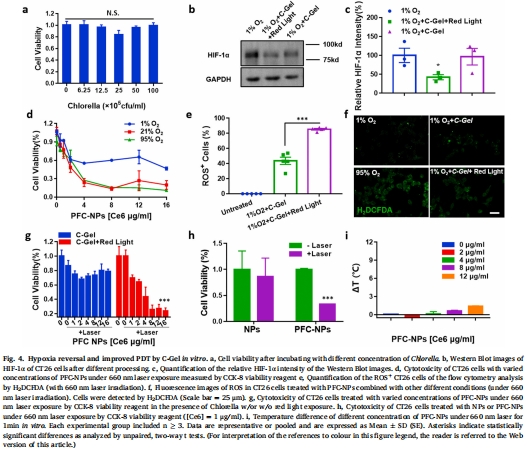
氧富集效應(yīng):PFC-NPs使1O?產(chǎn)量提升10倍(95% O?環(huán)境)(圖3f);
免疫激活:PDT處理的小球藻上清液促進(jìn)DC成熟(CD80/CD86↑)及炎癥因子分泌(IL-12/TNF-α↑)(圖7)。
體內(nèi)驗(yàn)證:
靶向蓄積:PFC-NPs在腫瘤內(nèi)8小時(shí)達(dá)峰;
光控氧生產(chǎn):原位C-Gel實(shí)現(xiàn)可逆氧生成(光照開啟→產(chǎn)氧,關(guān)閉→停止)(圖5b);
協(xié)同抑瘤:"C-Gel + PFC-NPs + 雙光照射"組腫瘤體積抑制90%(圖6c)。
4. 關(guān)鍵數(shù)據(jù)及研究意義
(1)小球藻產(chǎn)氧能力(圖2)
數(shù)據(jù):
C-Gel產(chǎn)氧量顯著高于游離小球藻(p<0.05)(圖2d);
不同pH下產(chǎn)氧穩(wěn)定(圖2f),儲存13天后存活率>90%(圖2h)。
意義:凝膠封裝提升小球藻的生物相容性與穩(wěn)定性,為體內(nèi)持續(xù)供氧奠定基礎(chǔ)。
(2)PFC的氧富集效應(yīng)(圖3)
數(shù)據(jù):
PFC-NPs使溶液氧濃度降低(去氧狀態(tài)),激光照射后氧消耗速率翻倍(圖3e);
1O?產(chǎn)量在95% O?環(huán)境下提升10倍(圖3f)。
意義:PFC通過高氧溶解度(20倍于水)解決PDT局部耗氧過快的瓶頸問題。
(3)體內(nèi)缺氧逆轉(zhuǎn)與療效(圖5-6)
數(shù)據(jù):
原位C-Gel使腫瘤HIF-1α表達(dá)降低50%(圖5e-f);
"C-Gel + PFC-NPs + 雙光"組腫瘤完全消退率30%(圖6c);
TUNEL染色顯示大面積腫瘤細(xì)胞凋亡(圖6e)。
意義:雙光調(diào)控(紅光產(chǎn)氧+660 nm激光觸發(fā)PDT)實(shí)現(xiàn)時(shí)空精準(zhǔn)治療。
(4)免疫激活(圖7)
數(shù)據(jù):
PDT處理的小球藻上清液使DC活化標(biāo)志物CD80?CD86?細(xì)胞增加2倍(圖7b);
IL-12p70和TNF-α分泌量分別提升6倍和20倍(圖7c-d)。
意義:小球藻作為天然免疫佐劑,協(xié)同PDT誘導(dǎo)抗腫瘤免疫應(yīng)答。
5. 核心結(jié)論
氧供給雙機(jī)制:小球藻光合作用提供持續(xù)氧源,PFC富集氧提升PDT效率;
光控精準(zhǔn)性:紅光(600–700 nm)調(diào)控產(chǎn)氧,660 nm激光觸發(fā)PDT,避免過度氧損傷;
免疫協(xié)同:PDT后小球藻釋放免疫刺激分子,增強(qiáng)DC活化和細(xì)胞免疫;
臨床潛力:該系統(tǒng)可擴(kuò)展至放療/免疫治療等氧依賴療法。
6. 丹麥Unisense電極的研究意義
技術(shù)應(yīng)用與數(shù)據(jù):
功能:采用Unisense OX-NP針式氧微電極(穿刺傳感器)實(shí)時(shí)監(jiān)測:
體外產(chǎn)氧動力學(xué):C-Gel光照下氧濃度變化曲線(圖2d,e,i);
體內(nèi)腫瘤氧分壓:原位監(jiān)測C-Gel在腫瘤內(nèi)的產(chǎn)氧能力(圖5b,d)。
關(guān)鍵發(fā)現(xiàn):
C-Gel在腫瘤內(nèi)產(chǎn)氧速率達(dá)500 μM/min(圖5d),為游離小球藻的30倍;
光控可逆性:光照開啟時(shí)氧分壓驟升,關(guān)閉后迅速回落(圖5b)。
科學(xué)價(jià)值:
高時(shí)空分辨率:
微電極(直徑1.6 mm)實(shí)現(xiàn)活體組織微區(qū)氧分壓動態(tài)監(jiān)測,克服傳統(tǒng)生化檢測的破壞性局限;
秒級響應(yīng)捕捉光合氧生成的"開關(guān)效應(yīng)",為光控療法提供實(shí)時(shí)反饋。
機(jī)制解析關(guān)鍵:
定量證實(shí)C-Gel逆轉(zhuǎn)腫瘤缺氧的能力(HIF-1α↓50%與氧分壓↑直接關(guān)聯(lián))(圖5e-f);
驗(yàn)證PFC的氧收集效率:PFC-NPs組氧消耗速率是普通NPs的2倍(圖3e)。
轉(zhuǎn)化醫(yī)學(xué)價(jià)值:
為PDT劑量優(yōu)化提供參數(shù):氧分壓>40 mmHg時(shí)1O?產(chǎn)量最大化(圖3f);
推動Unisense電極作為活體氧監(jiān)測金標(biāo)準(zhǔn),適用于微環(huán)境代謝研究。
領(lǐng)域貢獻(xiàn):
首次將光合生物氧生成與合成材料氧富集整合,解決PDT核心瓶頸;
確立Unisense電極在評估納米藥物氧管理效能中的不可替代性。
機(jī)制示意圖:
紅光照射 → 小球藻光合作用產(chǎn)氧 → PFC富集氧至光敏劑周圍 → Ce6生成1O? → 腫瘤細(xì)胞鐵死亡/凋亡
↓
PDT后小球藻釋放免疫因子 → DC活化 → 抗腫瘤免疫應(yīng)答
創(chuàng)新點(diǎn):
雙光調(diào)控:同一紅光波段控制氧生成與PDT觸發(fā),簡化臨床操作;
免疫增效:小球藻兼具"氧工廠"與"免疫佐劑"雙重角色,突破傳統(tǒng)PDT局限。
<strike id="yiuck"></strike>
<strike id="yiuck"></strike>