熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Linkage between bacterial community-mediated hydrogen peroxide detoxification and the growth of Microcystis aeruginosa
細菌群落介導的過氧化氫解毒與銅綠微囊藻生長的聯(lián)系
來源:Water Research 207 (2021) 117784
1. 摘要核心內(nèi)容
本研究揭示了缺乏過氧化氫酶(catalase)的銅綠微囊藻(Microcystis aeruginosa)依賴共生細菌群落抵御氧化脅迫的機制:
關鍵發(fā)現(xiàn):
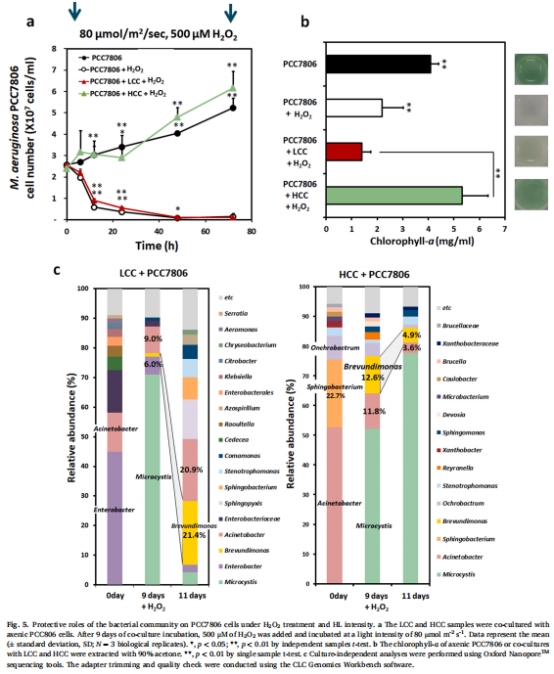
高光照(80 μmol m?2 s?1)誘導銅綠微囊藻產(chǎn)生過量H?O?,導致無菌藻細胞死亡(圖1a),而共生高過氧化氫酶活性細菌群落(HCC)可促進藻生長(圖5a)。
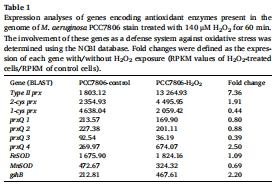
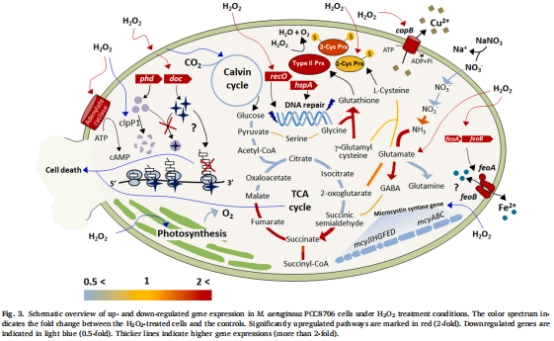
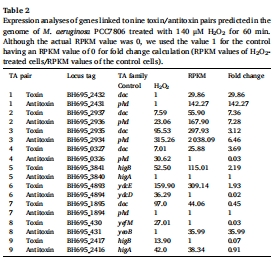
轉錄組分析顯示,H?O?脅迫下藻細胞上調(diào)抗氧化基因(如Ⅱ型過氧化物還原酶prx,7.36倍)和毒素-抗毒素系統(tǒng)(如doc基因30倍上調(diào)),但下調(diào)光合作用基因(如cpcA下調(diào)92%)(表1,圖3)。
富含α-變形菌(如Brevundimonas和Ochrobactrum)的HCC群落通過高過氧化氫酶活性加速H?O?分解,顯著提升藻光合活性和生長(圖5c,圖6)。
2. 研究目的
揭示共生機制:闡明細菌群落如何通過H?O?解毒保護缺乏過氧化氫酶的銅綠微囊藻。
識別關鍵菌群:篩選具有高H?O?解毒能力的細菌類群(如α-變形菌),解析其生態(tài)功能。
預測水華動態(tài):探究環(huán)境H?O?水平(光照與DOM驅(qū)動)對藻華形成的調(diào)控作用。
3. 研究思路
藻細胞脅迫響應:
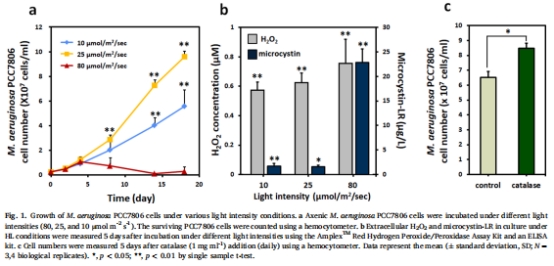
無菌銅綠微囊藻(PCC7806)暴露于高光照(80 μmol m?2 s?1),監(jiān)測生長、H?O?及微囊藻毒素產(chǎn)量(圖1)。
H?O?脅迫下轉錄組分析(140 μM H?O?處理),鑒定差異表達基因(圖3,表1-2)。
環(huán)境樣本分析:
采集15個淡水樣本(含藻華區(qū)與非藻華區(qū)),測定原位H?O?濃度、DOM含量及細菌群落組成(圖4)。
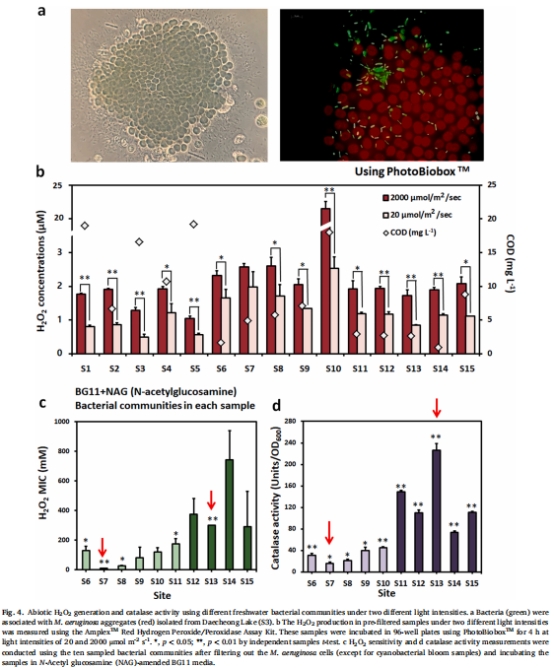
篩選高/低過氧化氫酶活性細菌群落(HCC/LCC)。
共培養(yǎng)實驗:
無菌藻分別與HCC/LCC共培養(yǎng),評估藻生長(圖5a)、葉綠素a含量(圖5b)及細菌群落演替(圖5c)。
解毒能力量化:
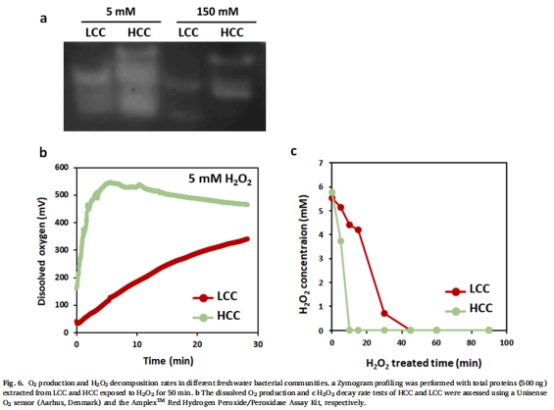
通過酶譜分析(zymogram)檢測過氧化氫酶活性(圖6a)。
丹麥Unisense O?電極實時監(jiān)測H?O?分解產(chǎn)生的O?(圖6b)。
4. 關鍵數(shù)據(jù)及研究意義
(1) 藻細胞生長與脅迫響應(圖1)
數(shù)據(jù):高光照(80 μmol m?2 s?1)導致無菌藻死亡(細胞計數(shù)下降),伴隨H?O?積累(0.8 μM)和微囊藻毒素釋放(14倍增加)(圖1b)。
意義:證實光照誘導的H?O?是藻細胞死亡主因,為共生細菌的保護作用提供依據(jù)。
(2) 轉錄組分析(圖3,表1-2)
數(shù)據(jù):
上調(diào)基因:Ⅱ型prx(7.36倍)、毒素-抗毒素系統(tǒng)(如doc基因30倍)、DNA修復基因(recO52倍)。
下調(diào)基因:光合作用相關基因(cpcA下調(diào)92%)、微囊藻毒素合成基因(mcyA-E)。
意義:揭示藻細胞通過激活抗氧化與休眠機制應對H?O?脅迫,但犧牲光合產(chǎn)能。
(3) 細菌群落結構(圖5c)
數(shù)據(jù):HCC群落中α-變形菌(如Brevundimonas)占比達17%,共培養(yǎng)后成為優(yōu)勢類群(LCC中占比升至12.6%)。
意義:α-變形菌通過過氧化氫酶活性成為藻細胞的“抗氧化護衛(wèi)”。
(4) 過氧化氫酶活性與O?生成(圖6)
數(shù)據(jù):
酶譜顯示HCC含多種過氧化氫酶(分子量多樣),活性顯著高于LCC(圖6a)。
Unisense電極數(shù)據(jù):HCC的O?生成速率比LCC快3倍(5 mM H?O?處理下8分鐘內(nèi)達峰值)(圖6b)。
意義:量化細菌群落對H?O?的解毒效率,直接關聯(lián)解毒動力學與藻保護效應。
5. 核心結論
藻-菌共生依賴:銅綠微囊藻依賴共生細菌(尤其是α-變形菌)的過氧化氫酶解毒H?O?,維持高光照下的生長。
環(huán)境驅(qū)動機制:淡水DOM的光催化(產(chǎn)生H?O?)與細菌解毒能力共同調(diào)控藻華形成。
技術啟示:調(diào)控水體細菌群落組成(如富集HCC)可能抑制藻華暴發(fā)。
6. 丹麥Unisense電極數(shù)據(jù)的詳細解讀
技術原理與方法
設備型號:Unisense O?微電極(響應時間<10秒)。
測量過程:
細菌群落暴露于5 mM H?O?,實時監(jiān)測溶液O?濃度變化。
H?O?分解反應:2H?O? → 2H?O + O?,O?生成速率直接反映過氧化氫酶活性。
關鍵發(fā)現(xiàn)與意義
解毒動力學量化:
HCC的O?生成速率峰值(~25 μmol L?1 min?1)顯著高于LCC(~8 μmol L?1 min?1)(圖6b)。
→ 意義:首次實時捕獲細菌群落對H?O?的分解能力,揭示解毒效率差異是藻保護作用的關鍵。
生態(tài)機制驗證:
快速O?生成對應藻光合活性提升(圖5b),因H?O?清除減少PSII氧化損傷。
→ 意義:建立“細菌解毒速率→藻光合恢復→生長促進”的因果鏈條。
方法學優(yōu)勢:
高時空分辨率:秒級監(jiān)測O?動態(tài),優(yōu)于終點法測定(如分光光度法)。
原位無損:避免樣品處理導致的酶活性失真,真實反映群落生理狀態(tài)。
理論與應用價值
理論創(chuàng)新:挑戰(zhàn)“藻華僅由營養(yǎng)鹽驅(qū)動”的傳統(tǒng)認知,提出“菌群抗氧化服務”新范式。
應用方向:
藻華預警:監(jiān)測水體H?O?生成與細菌過氧化氫酶活性,預測藻華暴發(fā)風險。
生態(tài)修復:定向引入高過氧化氫酶菌株(如Brevundimonas),抑制有害藻華。
總結
本研究通過多尺度實驗證實:
銅綠微囊藻的生存策略:依賴共生細菌(α-變形菌)的過氧化氫酶抵御H?O?脅迫(圖5-6)。
Unisense電極的核心作用:量化細菌解毒動力學,揭示O?生成速率是藻保護效能的直接指標(圖6b)。
管理啟示:調(diào)控淡水微生物群落結構可為藻華防控提供新路徑。
<strike id="yiuck"></strike>
<strike id="yiuck"></strike>