熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Inhaled H2 or CO2 Do Not Augment the Neuroprotective Effect of Therapeutic Hypothermia in a Severe Neonatal Hypoxic-Ischemic Encephalopathy Piglet Model
吸入H 2 或CO2不會增強嚴(yán)重新生兒缺氧缺血性腦病仔豬模型中低溫治療的神經(jīng)保護作用
來源:Int. J. Mol. Sci. 2020, 21, 6801;
1. 論文摘要核心內(nèi)容
研究通過建立嚴(yán)重HIE豬模型(20分鐘窒息誘導(dǎo)),評估了低溫療法(TH)單獨或聯(lián)合吸入H?(2.1%)或CO?(分級恢復(fù)正常碳酸血癥)的神經(jīng)保護效果。結(jié)果顯示:
TH僅在尾狀核(caudate nucleus)顯著減輕神經(jīng)元損傷,但對海馬區(qū)(hippocampus)無效。
H?或CO?聯(lián)合TH未增強神經(jīng)保護作用;CO?甚至可能削弱TH在尾狀核的保護效果。
基因表達分析:海馬區(qū)凋亡誘導(dǎo)因子(AIF)和半胱天冬酶-3(caspase-3)mRNA水平在TH組升高10倍,與TH的區(qū)域特異性保護效果一致。
結(jié)論:不支持H?或CO?作為TH的輔助療法用于HIE治療。
2. 研究目的
評估H?或CO?能否增強TH的神經(jīng)保護作用,以改善嚴(yán)重HIE患兒的預(yù)后。
探究窒息后腦區(qū)特異性損傷機制及TH的分子調(diào)控(BDNF、AIF、caspase-3基因表達)。
3. 研究思路
1.動物模型建立:
新生豬窒息模型(20分鐘4% O? + 20% CO?通氣),模擬嚴(yán)重HIE(圖1)。
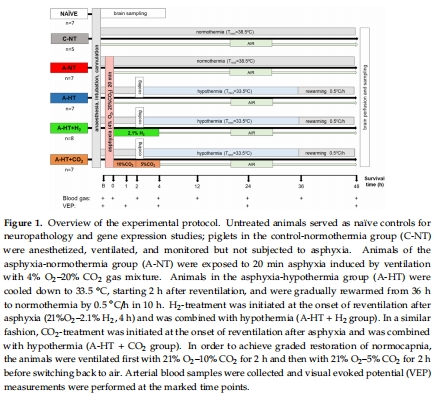
2.分組設(shè)計:
對照組(C-NT)、窒息+常溫(A-NT)、窒息+低溫(A-HT)、A-HT+H?、A-HT+CO?(圖1)。
3.干預(yù)措施:
TH(33.5°C,窒息后2–36小時);H?(窒息后4小時);CO?(分級恢復(fù)碳酸血癥)。
4.多維度評估:
生理參數(shù)(體溫、血壓、血氣,圖2–3)。
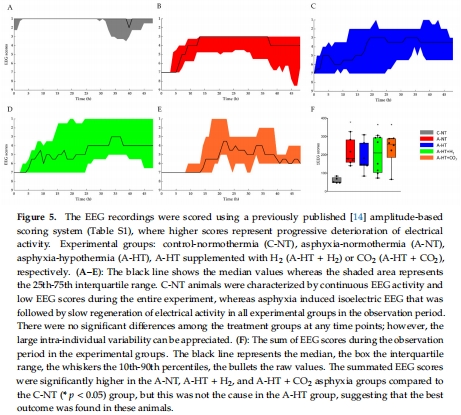
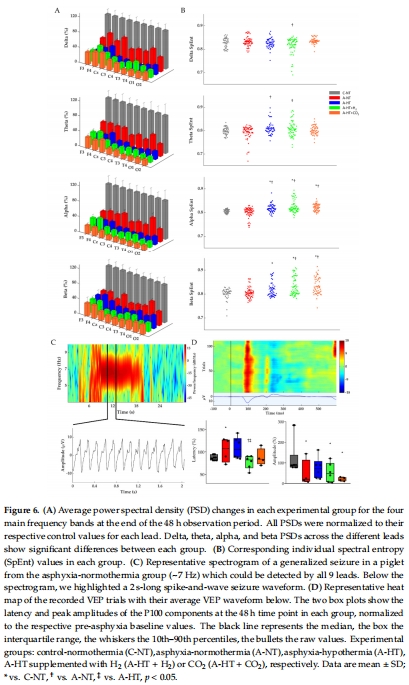
腦電活動(EEG功率譜密度PSD、頻譜熵SpEnt、視覺誘發(fā)電位VEP,圖5–6)。
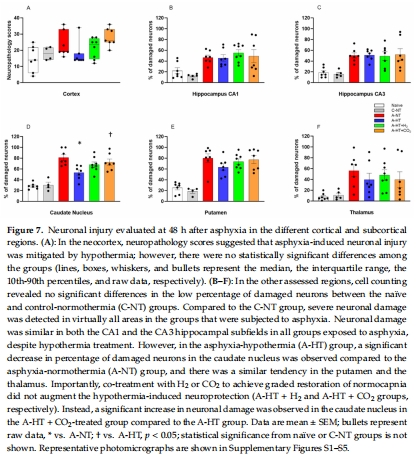
神經(jīng)病理學(xué)(神經(jīng)元損傷評分,圖7)。
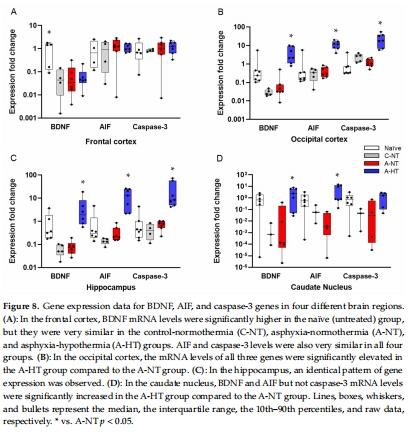
基因表達(BDNF、AIF、caspase-3 mRNA,圖8)。
4. 關(guān)鍵數(shù)據(jù)及研究意義
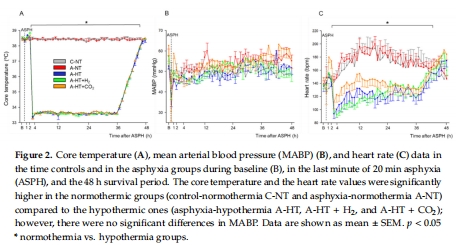
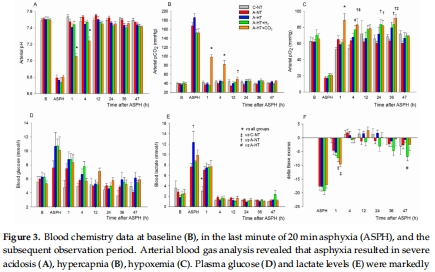
(1) 生理參數(shù)(圖2–3)
數(shù)據(jù):窒息導(dǎo)致嚴(yán)重低氧(pO?=19±5 mmHg)、混合酸中毒(pH=6.79±0.10),TH降低心率(圖2C)。
意義:證實模型成功模擬臨床嚴(yán)重HIE,TH對心血管系統(tǒng)有顯著影響。
(2) 腦組織H?濃度(圖4)
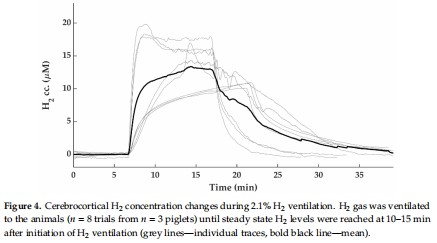
數(shù)據(jù):使用丹麥Unisense H?微電極實時監(jiān)測,H?吸入后10–15分鐘腦皮質(zhì)H?濃度達穩(wěn)態(tài)(13.1±3.4 μM)。
意義:首次在大型動物中直接證實H?可快速穿透血腦屏障,為H?療法的藥代動力學(xué)提供關(guān)鍵證據(jù)。
(3) 腦電活動(圖5–6)
數(shù)據(jù):
EEG評分顯示窒息后電活動抑制,TH組恢復(fù)最佳(圖5F)。
VEP的P100波幅衰減(圖6D),提示視覺通路損傷。
意義:EEG和VEP是HIE神經(jīng)功能損傷的敏感指標(biāo),TH可部分改善電生理異常。
(4) 神經(jīng)病理學(xué)(圖7)
數(shù)據(jù):
TH顯著減少尾狀核神經(jīng)元損傷(圖7B–F),但對海馬區(qū)無效。
CO?聯(lián)合TH加重尾狀核損傷(圖7D)。
意義:TH的保護作用具有腦區(qū)特異性,CO?可能干擾TH的神經(jīng)保護機制。
(5) 基因表達(圖8)
數(shù)據(jù):
TH上調(diào)海馬區(qū)BDNF、AIF、caspase-3 mRNA(圖8C),尾狀核僅BDNF和AIF升高(圖8D)。
意義:基因表達差異解釋了TH的區(qū)域特異性保護效果,提示凋亡通路參與HIE損傷。
5. 丹麥Unisense電極數(shù)據(jù)的深層意義
(1) 技術(shù)應(yīng)用背景
電極型號:Unisense H?微電極(直徑50μm),CAL300校準(zhǔn)系統(tǒng)(方法部分)。
功能:實時監(jiān)測腦組織H?濃度,驗證H?吸入治療的生物可利用度。
(2) 研究意義
1.治療劑量的直接證據(jù):
測得腦組織H?濃度(13.1±3.4 μM)與嚙齒類神經(jīng)保護研究中的有效濃度一致(圖4),證實H?可達到治療水平。
2.動力學(xué)特征:
H?濃度在10–15分鐘達穩(wěn)態(tài),支持早期干預(yù)的可行性(窒息后立即給藥)。
3.轉(zhuǎn)化醫(yī)學(xué)價值:
為大型動物模型中的H?藥代動力學(xué)研究設(shè)立金標(biāo)準(zhǔn),克服了既往依賴間接血藥濃度的局限。
4.局限性啟示:
未監(jiān)測窒息或低溫狀態(tài)下H?濃度變化,未來需結(jié)合動態(tài)腦血流數(shù)據(jù)優(yōu)化給藥方案。
6. 研究結(jié)論
1.TH的局限性:僅對尾狀核有保護作用,海馬區(qū)損傷未改善。
2.輔助療法無效:H?或CO?聯(lián)合TH無協(xié)同保護作用,CO?可能拮抗TH效果。
3.分子機制:TH通過上調(diào)BDNF和凋亡相關(guān)基因(AIF/caspase-3)發(fā)揮區(qū)域特異性保護,但可能同時激活促凋亡通路。
4.臨床意義:不支持H?或CO?作為TH的輔助療法用于嚴(yán)重HIE。
7. 核心圖示
TH的區(qū)域特異性保護與輔助療法失敗機制:
[窒息損傷] → [TH激活尾狀核BDNF/AIF] → [神經(jīng)保護]
↑
[海馬區(qū)凋亡基因持續(xù)高表達] → [TH無效]
↓
[CO?干擾TH保護] → [尾狀核損傷加重]
研究啟示:
丹麥Unisense電極通過高時空分辨率實時監(jiān)測腦組織H?濃度,為氣體療法的轉(zhuǎn)化研究提供了不可替代的藥代動力學(xué)證據(jù)。未來需探索H?在低溫或缺血條件下的滲透規(guī)律,并聯(lián)合多模態(tài)監(jiān)測(如腦血流、代謝)以優(yōu)化神經(jīng)保護策略。
<strike id="yiuck"></strike>
<strike id="yiuck"></strike>