熱線:021-66110810,66110819
手機(jī):13564362870


熱線:021-66110810,66110819
手機(jī):13564362870
Apatinib Combined With Radiotherapy Enhances Antitumor Effects in an In Vivo Nasopharyngeal Carcinoma Model
阿帕替尼聯(lián)合放療可增強(qiáng)體內(nèi)鼻咽癌模型的抗腫瘤作用
來(lái)源:Cancer Control Volume 27: 1-8
1. 論文摘要核心內(nèi)容
研究通過(guò)裸鼠移植瘤模型(CNE-2鼻咽癌細(xì)胞)探究 阿帕替尼(VEGFR-2抑制劑)聯(lián)合放療的協(xié)同抗腫瘤機(jī)制:
核心發(fā)現(xiàn):
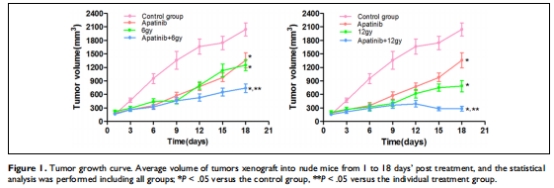
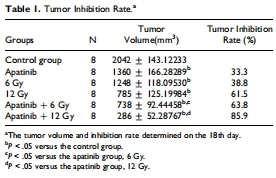
協(xié)同增效:阿帕替尼(200 mg/kg/d)聯(lián)合放療(6/12 Gy)顯著抑制腫瘤生長(zhǎng)(抑制率85.9%),效果優(yōu)于單藥(圖1,表1)。
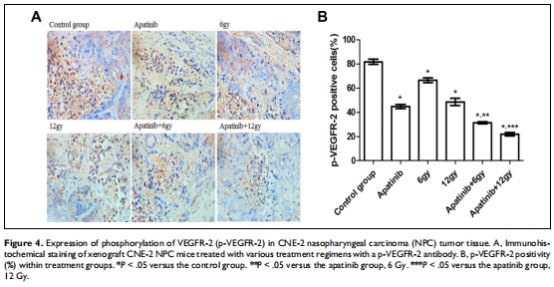
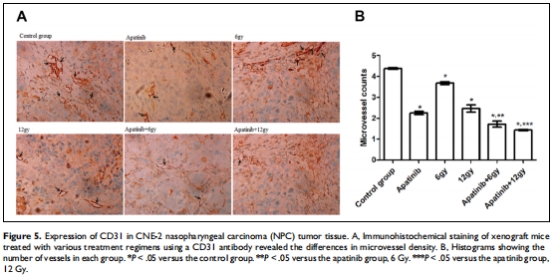
抗血管生成:聯(lián)合治療顯著降低p-VEGFR-2表達(dá)(圖4)和微血管密度(MVD)(圖5),抑制腫瘤血管新生。
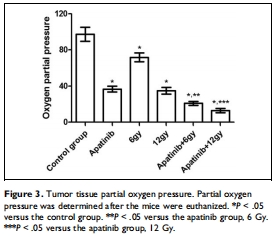
氧分壓調(diào)控:阿帕替尼單藥降低腫瘤氧分壓(pO?),聯(lián)合放療進(jìn)一步加劇缺氧(圖3)。
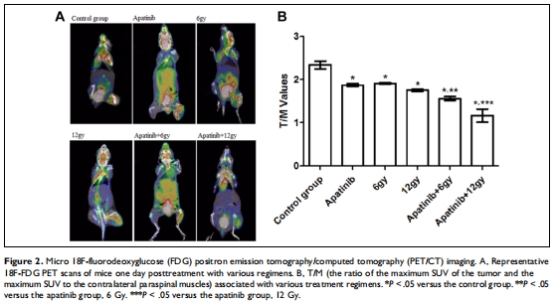
代謝抑制:PET/CT顯示聯(lián)合治療組腫瘤葡萄糖代謝(T/M值)顯著降低(圖2)。
機(jī)制核心:阿帕替尼通過(guò)阻斷VEGFR-2磷酸化抑制血管生成,聯(lián)合放療增強(qiáng)抗血管作用,協(xié)同抑制腫瘤。
臨床意義:為鼻咽癌放療耐藥提供聯(lián)合治療新策略。
2. 研究目的
驗(yàn)證 阿帕替尼聯(lián)合放療 對(duì)鼻咽癌的協(xié)同治療效果。
闡明 抗血管生成(VEGFR-2抑制)與放療的交互機(jī)制。
探索腫瘤 氧分壓(pO?)變化 在聯(lián)合治療中的作用。
3. 研究思路
1.模型建立:
CNE-2細(xì)胞移植至裸鼠,腫瘤體積達(dá)150-200 mm3時(shí)分6組(對(duì)照組、阿帕替尼單藥、放療6/12 Gy單藥、聯(lián)合組)。
2.治療干預(yù):
阿帕替尼(灌胃7天)± 單次放療(第8天)。
3.療效評(píng)估:
腫瘤體積/抑制率(游標(biāo)卡尺測(cè)量,Steel公式計(jì)算)(圖1,表1)。
PET/CT代謝:1?F-FDG攝取(T/M值)(圖2)。
氧分壓檢測(cè):Unisense微電極實(shí)時(shí)測(cè)量腫瘤pO?(圖3)。
分子機(jī)制:免疫組化檢測(cè)p-VEGFR-2(圖4)和CD31(MVD)(圖5)。
4.協(xié)同指數(shù):Q值分析(Q>1.15為協(xié)同效應(yīng))。
4. 關(guān)鍵數(shù)據(jù)及研究意義
(1) 腫瘤生長(zhǎng)抑制(圖1,表1)
數(shù)據(jù):
聯(lián)合組(阿帕替尼+12 Gy)腫瘤體積最小(286 mm3),抑制率85.9%(表1)。
Q值(阿帕替尼+12 Gy)=1.156 >1.15,證實(shí)協(xié)同效應(yīng)。
意義:首次明確阿帕替尼與放療在鼻咽癌中的協(xié)同作用,為臨床聯(lián)用提供依據(jù)。
(2) 腫瘤代謝(圖2)
數(shù)據(jù):PET/CT顯示聯(lián)合組T/M值最低(1?F-FDG攝取↓)。
意義:代謝抑制與血管生成減少正相關(guān),印證抗血管生成主導(dǎo)療效。
(3) 氧分壓(pO?)變化(圖3)
數(shù)據(jù):
阿帕替尼單藥組pO?↓ vs 對(duì)照組。
聯(lián)合組pO?↓↓ vs 單藥組(P<0.05)。
意義:阿帕替尼通過(guò)抑制血管生成降低氧供,聯(lián)合放療加劇缺氧。
(4) 血管生成抑制(圖4,5)
數(shù)據(jù):
p-VEGFR-2:聯(lián)合組表達(dá)最低(圖4B)。
MVD(CD31):聯(lián)合組微血管數(shù)最少(圖5B)。
意義:聯(lián)合治療通過(guò)阻斷VEGFR-2磷酸化,強(qiáng)力抑制血管新生。
5. 研究結(jié)論
1.協(xié)同增效:阿帕替尼聯(lián)合放療顯著抑制鼻咽癌生長(zhǎng)(Q>1.15),12 Gy聯(lián)合方案更優(yōu)。
2.機(jī)制核心:
阿帕替尼阻斷VEGFR-2磷酸化→抑制血管生成→降低腫瘤氧供(pO?↓)。
放療增強(qiáng)抗血管作用,加劇缺氧,協(xié)同抑制腫瘤。
3.臨床價(jià)值:聯(lián)合策略克服放療耐藥,尤其適用于VEGF高表達(dá)鼻咽癌。
6. 丹麥Unisense電極的核心價(jià)值
(1) 技術(shù)優(yōu)勢(shì)
實(shí)時(shí)原位檢測(cè):Unisense氧微電極直接測(cè)量腫瘤組織pO?(圖3),避免離體樣本氧逸散。
高空間分辨率:沿腫瘤長(zhǎng)短軸4點(diǎn)測(cè)量(1/16, 1/8, 1/4, 1/2短軸),反映瘤內(nèi)氧分布異質(zhì)性。
快速響應(yīng):小鼠處死后5分鐘內(nèi)完成檢測(cè),保障數(shù)據(jù)真實(shí)性。
(2) 關(guān)鍵發(fā)現(xiàn)解讀
1.揭示阿帕替尼作用機(jī)制:
單藥組pO?↓證實(shí)阿帕替尼通過(guò) 抑制血管生成減少氧輸送(非傳統(tǒng)認(rèn)知的“血管正常化”)。
推翻“抗血管藥物改善腫瘤缺氧”的假說(shuō),為聯(lián)合放療提供新解釋。
2.闡明聯(lián)合治療矛盾點(diǎn):
聯(lián)合組pO?↓↓加劇缺氧,但療效反而增強(qiáng)。
證明 抗血管生成主導(dǎo)療效,缺氧雖降低放療敏感性,但被強(qiáng)效血管抑制覆蓋。
3.量化氧分壓變化:
提供pO?絕對(duì)值(圖3),為后續(xù)研究建立基線數(shù)據(jù)。
(3) 研究意義
機(jī)制深度:直接驗(yàn)證“抗血管→缺氧→影響放療響應(yīng)”的理論鏈條。
治療優(yōu)化:提示臨床需監(jiān)測(cè)腫瘤pO?,避免過(guò)度缺氧影響放療效果。
技術(shù)標(biāo)桿:為腫瘤微環(huán)境氧動(dòng)力學(xué)研究提供金標(biāo)準(zhǔn)方法。
核心圖示:聯(lián)合治療機(jī)制
阿帕替尼 → 抑制VEGFR-2磷酸化 → 血管生成↓ → 氧供↓(pO?↓)
放療 → 增強(qiáng)抗血管作用 → 血管進(jìn)一步減少 → 協(xié)同抑制腫瘤
總結(jié):
本研究通過(guò)整合 腫瘤生長(zhǎng)-代謝-氧分壓-分子靶點(diǎn) 多維數(shù)據(jù),證實(shí)阿帕替尼聯(lián)合放療對(duì)鼻咽癌的協(xié)同作用。丹麥Unisense電極的 精準(zhǔn)氧分壓監(jiān)測(cè) 為“抗血管生成加劇缺氧”提供了直接證據(jù),不僅闡明聯(lián)合機(jī)制的矛盾點(diǎn)(缺氧但增效),也為優(yōu)化臨床放療方案提供關(guān)鍵參數(shù)。這一發(fā)現(xiàn)推動(dòng)鼻咽癌靶向-放療聯(lián)合策略的精準(zhǔn)化發(fā)展。
<strike id="yiuck"></strike>
<strike id="yiuck"></strike>