熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Efficacy-shaping nanomedicine by loading Calcium Peroxide into Tumor Microenvironment-responsive Nanoparticles for the Antitumor Therapy of Prostate Cancer
通過將過氧化鈣負載到腫瘤微環境響應納米顆粒中用于前列腺癌的抗腫瘤治療
來源:Theranostics 2020, Vol. 10, Issue 21
1. 論文摘要核心內容
本研究開發了一種基于腫瘤微環境(TME)響應型納米系統(CaO?@HMSNs-PAA),用于前列腺癌靶向治療:
載體設計:中空介孔二氧化硅納米顆粒(HMSNs)負載過氧化鈣(CaO?),表面包覆聚丙烯酸(PAA)作為pH響應門控。
作用機制:酸性TME(pH≈6.5)觸發CaO?釋放H?O?,在腫瘤細胞內生成高濃度活性氧(ROS),通過線粒體凋亡通路誘導癌細胞死亡。
療效優勢:顯著抑制前列腺癌細胞(PC-3)增殖(體外存活率降至42.6%),在動物模型中腫瘤體積縮小58%,且對正常組織無損傷。
創新概念:提出“療效重塑納米醫學”(Efficacy-shaping Nanomedicine),將無活性的CaO?轉化為TME響應型抗腫瘤制劑。
2. 研究目的
1.解決臨床痛點:傳統放化療缺乏腫瘤選擇性,副作用大。
2.利用TME特性:基于腫瘤組織酸性環境(pH 6.5 vs. 正常組織pH 7.4)設計pH響應藥物遞送系統。
3.開發安全ROS源:通過納米載體實現CaO?的靶向釋放,避免全身毒性。
3. 研究思路
1.納米系統構建(Scheme 2):
合成HMSNs(中空結構提高載藥量)→ 氨基化修飾(HMSNs-NH?)→ 負載CaO? → PAA涂層(pH響應門控)。
2.材料表征(圖1-2):
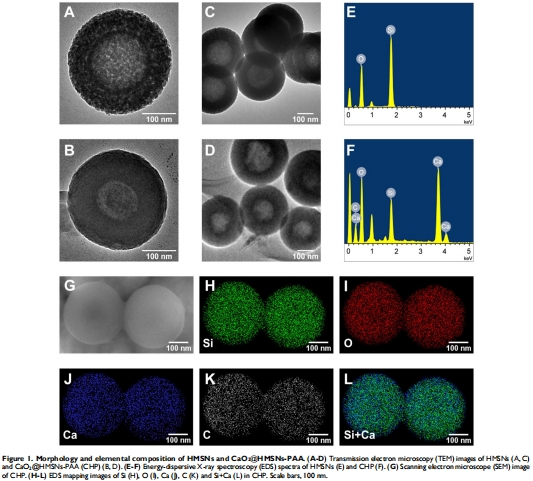
TEM/EDS確認HMSNs空腔結構(直徑300nm)及CaO?成功負載(圖1B,D,F);
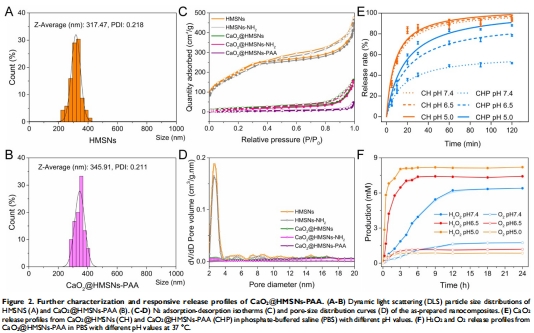
BET分析顯示PAA涂層使比表面積從779m2/g降至12m2/g(圖2C),證明孔道封閉。
3.體外驗證:
釋放動力學:pH 5.0時CaO?釋放率88.2%(vs. pH 7.4時51.7%)(圖2E);
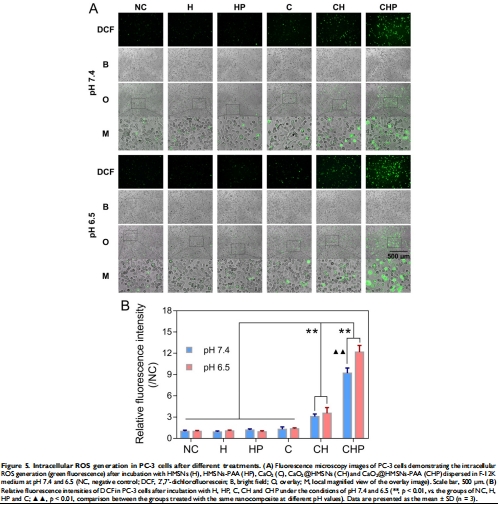
細胞攝取:CLSM顯示納米顆粒3h內富集于溶酶體(圖3);

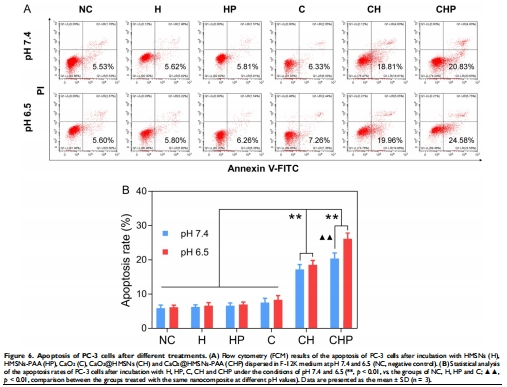
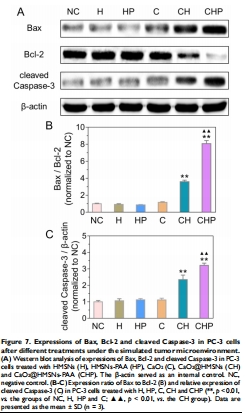
抗腫瘤機制:ROS誘導線粒體凋亡(Bax/Bcl-2↑,Caspase-3激活)(圖5-7)。
4.體內評價:
靶向性:EPR效應使腫瘤蓄積量24h達10.84%(圖8A);
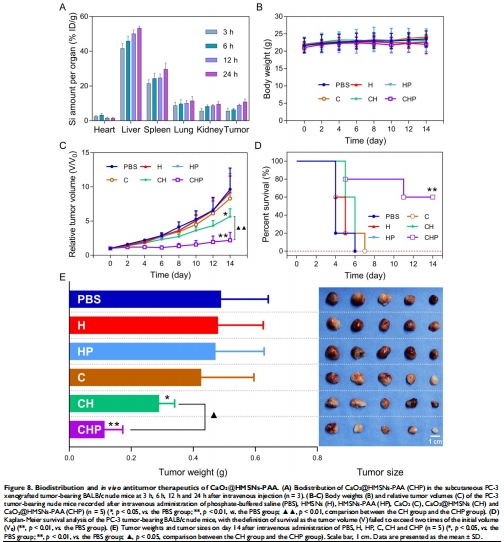
療效:單次給藥后腫瘤體積抑制率58%(圖8C),生存期延長(圖8D)。
4. 關鍵數據及研究意義
(1) pH響應釋放(圖2E-F)
數據:pH 5.0時CaO?釋放率88.2%(vs. pH 7.4時51.7%);H?O?產量在pH 5.0時為pH 7.4的2.3倍(丹麥Unisense電極測量)。
意義:證實納米系統在酸性TME中高效釋放ROS,實現腫瘤選擇性殺傷。
(2) 體外抗腫瘤效果(圖4)
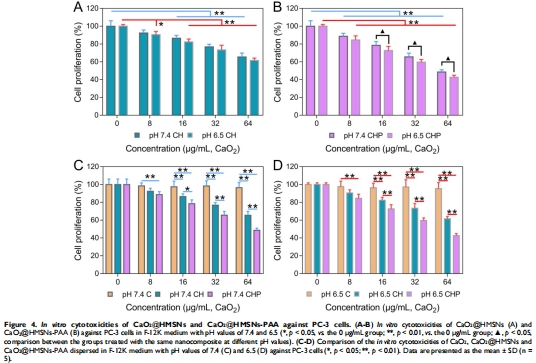
數據:pH 6.5時,CaO?@HMSNs-PAA使PC-3細胞存活率降至42.6%(vs. pH 7.4時48.5%);游離CaO?無顯著毒性(存活率96.5%)。
意義:納米載體提升CaO?生物利用度,TME微酸環境增強療效。
(3) 凋亡機制(圖6-7)
數據:
凋亡率26.1%(pH 6.5 vs. 20.4% pH 7.4)(圖6);
Bax/Bcl-2比值升高3倍,Cleaved Caspase-3表達上調(圖7)。
意義:ROS通過線粒體通路誘導凋亡,為分子機制提供證據。
(4) 體內療效(圖8)
數據:治療組腫瘤重量下降52%(vs. 對照組);H&E染色顯示腫瘤結構破壞(圖S18)。
意義:納米系統實現靶向治療,避免全身毒性(肝腎功能指標正常,圖S13)。
5. 丹麥Unisense電極的核心價值
(1) 技術原理
功能:實時監測溶液中O?/H?O?濃度動態變化(方法2.6)。
實驗設計:在模擬TME(pH 5.0-7.4)中量化CaO?@HMSNs-PAA的ROS釋放動力學(圖2F)。
(2) 關鍵發現(圖2F)
pH依賴性:酸性環境(pH 5.0)下H?O?產量顯著升高(pH 5.0 vs. pH 7.4:峰值濃度差2.3倍),而O?生成減少67%。
動力學曲線:H?O?釋放呈緩釋特征(120min達平臺期),符合偽零級動力學。
(3) 研究意義
機制驗證:直接證明CaO?水解路徑的pH依賴性——酸性環境促進H?O?而非O?生成,為選擇性抗腫瘤提供化學基礎。
療效優化依據:量化ROS釋放效率,指導納米載體設計(如PAA涂層厚度優化)。
技術優勢:相比傳統終點法(如H?O?試劑盒),Unisense提供實時動態數據,揭示時間-濃度關聯性,避免采樣誤差。
6. 結論
1.納米系統有效性:CaO?@HMSNs-PAA通過TME觸發釋放ROS,顯著抑制前列腺癌生長(體外IC??=16μg/mL,體內腫瘤抑制率58%)。
2.安全性:載體材料(HMSNs/PAA)無顯著毒性,正常組織ROS可被抗氧化系統清除。
3.臨床價值:為前列腺癌提供“療效重塑”策略,兼具靶向性、安全性和高效性。
4.Unisense電極貢獻:通過精準量化ROS動力學,為pH響應機制提供不可替代的實驗證據,推動納米藥物設計從經驗向數據驅動轉變。
總結
本研究通過丹麥Unisense電極的動態監測,結合多維度實驗驗證,首次闡明:
1.CaO?的pH響應本質:酸性環境優先生成H?O?(非O?),為腫瘤選擇性氧化損傷奠定基礎。
2.納米載體的核心作用:PAA門控協同CaO?化學特性,實現ROS的時空可控釋放。
3.Unisense技術的不可替代性:
揭示釋放動力學細節,優化給藥方案;
提供ROS生成的直接證據,超越間接檢測方法(如熒光探針);
推動納米醫學從“定性設計”邁向“定量調控”。
該研究為前列腺癌靶向治療提供了新范式,Unisense電極在此過程中發揮了關鍵的機制解碼作用。
<strike id="yiuck"></strike>
<strike id="yiuck"></strike>