熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Bacteria coated cathodes as an in-situ hydrogen evolving platform for microbial electrosynthesis
作為微生物電合成中原位產氫平臺的細菌涂層陰極
來源:Scientific Reports, volume 10, article number: 19852, 2020
《科學報告》,第10卷,文章編號19852,2020年
摘要內容
該研究探討了在微生物電合成(MES)中,氫氣作為關鍵中間體在二氧化碳還原中的作用。研究使用十種來自不同屬(Rhodobacter, Rhodopseudomonas, Rhodocyclus, Desulfovibrio, Sporomusa)的細菌菌株,在-1.0 V vs. Ag/AgCl電位下形成單菌種生物膜陰極,并利用二氧化碳作為碳源,通過微傳感器實時監測氫氣產量。結果表明,其中八種菌株表現出電活性,兩種Desulfovibrio菌株(D. paquesii和D. desulfuricans)的產氫速率顯著高于非生物條件(提高2至8倍)。D. paquesii DSM 16681的產氫速率最高(45.6±18.8 μM min?1),但其單位生物量的產氫效率與其他菌株相似。研究強調了不同菌株在產氫能力上的差異,為開發穩定的產氫生物陰極平臺提供了依據。
研究目的
篩選和評估十種潛在產氫細菌在生物陰極上的產氫性能,以確定最適合用于微生物電合成中作為穩定產氫平臺的菌株,并為構建產氫菌與同型產乙酸菌的共培養體系奠定基礎。
研究思路:
1 選擇十種已報道的潛在產氫細菌菌株。
2 在碳布陰極上形成單菌種生物膜,使用標準化反應器設計和操作條件以減少外部變量影響。
3 在-1.0 V vs. Ag/AgCl電位下運行生物電化學系統(BES),以CO?為唯一碳源。
4 使用Unisense微傳感器實時監測氫氣產量,并與非生物條件對比。
5 通過qPCR測量生物膜中16S rRNA基因拷貝數以評估生物膜穩定性。
6 利用循環伏安法(CV)表征菌株的電化學活性。
7 分析產氫速率、電流需求、能效和庫侖效率等參數。
8 比較不同菌株的長期產氫穩定性及機制。
測量的數據及研究意義:
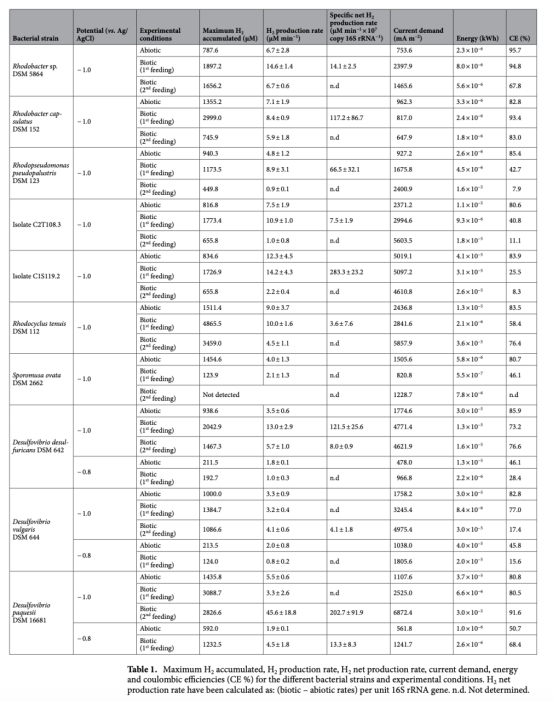
1 氫氣生產速率(μM min?1):通過Unisense微傳感器實時監測,數據來自圖2、圖3和表1。意義:直接評估各菌株在生物陰極上的產氫效率,區分生物與非生物貢獻,識別高效產氫菌株。
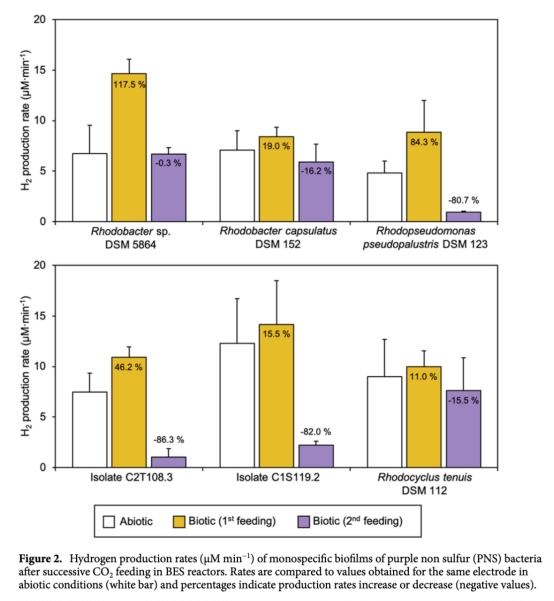
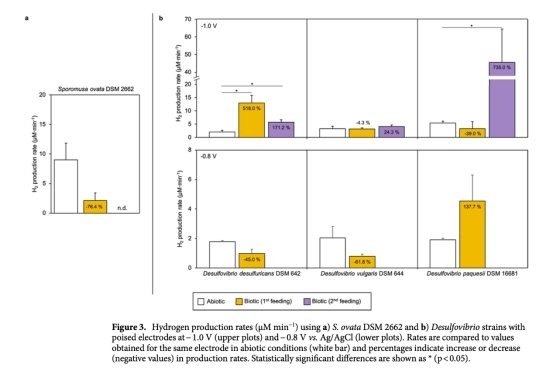
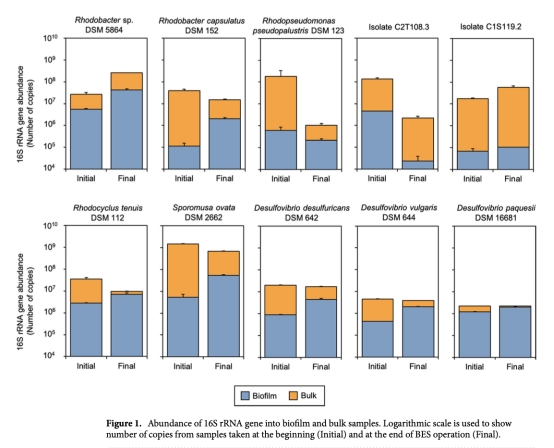
2 生物膜穩定性(16S rRNA基因拷貝數/cm2或/mL):通過qPCR測量,數據來自圖1。意義:確認生物膜在電極表面的附著和生長情況,評估菌株在電化學環境下的存活和穩定性。
3 電流需求(mA m?2)和能量消耗(kWh):數據來自表1。意義:反映產氫過程的電化學效率,評估系統能耗和經濟可行性。
4 庫侖效率(CE%):數據來自表1。意義:衡量電子用于產氫的比例,評估菌株的電子利用效率。
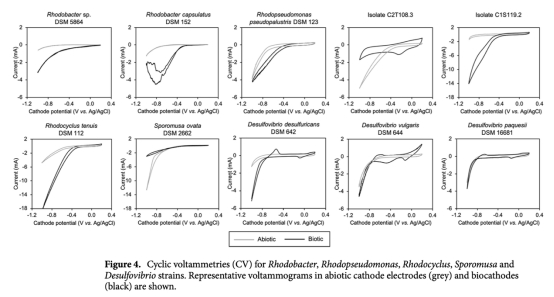
5 循環伏安(CV)曲線:數據來自圖4。意義:檢測菌株的電化學活性,識別氧化還原峰,揭示電子轉移機制。
6 pH變化。意義:監控反應環境變化,評估pH對產氫熱力學和菌株代謝的影響。
7 乙酸濃度。意義:驗證產氫消耗用于代謝產物合成,解釋氫氣凈值變化。
結論:
1 十種測試菌株中八種表現出電活性,但產氫能力差異顯著。
2 兩種Desulfovibrio菌株(D. desulfuricans DSM 642和D. paquesii DSM 16681)表現出持續且高效的產氫性能,尤其在長期操作中產氫速率顯著高于非生物條件。
3 部分菌株(如Rhodopseudomonas spp.)初始產氫高但隨CO?補充下降,可能涉及氫氣消耗或代謝轉換。
4 S. ovata因快速消耗氫氣用于產乙酸,不適合作為凈產氫平臺。
5 Desulfovibrio菌株因其高穩定性和產氫效率,是構建產氫生物陰極共培養體系的最佳候選。
詳細解讀使用丹麥Unisense電極測量數據的研究意義:
使用Unisense微傳感器實時監測氫氣濃度具有高時空分辨率優勢,能準確捕捉生物陰極表面的動態產氫過程。其研究意義包括:
1 實現原位實時監測,避免傳統離線采樣導致的誤差,提供更精確的產氫速率計算(基于初始25分鐘線性響應)。
2 高靈敏度能區分微小濃度變化,有效識別生物與非生物產氫的差異,如D. paquesii的產氫速率顯著超出非生物背景。
3 直接接觸液體測量,減少氣液平衡延遲,準確反映生物催化產氫的真實效率。
4 連續監測結合CO? flushing實驗,揭示菌株產氫的穩定性及代謝適應性(如第二次CO?補充后產氫下降或提升)。
5 數據支持定量分析比產氫速率(單位生物量),客觀比較菌株性能,排除生物膜密度干擾。
6 為機制推斷提供依據,如產氫速率與電流需求、庫侖效率的關聯,驗證電子流向氫氣生產的效率。
7 輔助驗證生物膜的電活性(通過CV),關聯電化學信號與實際產氫輸出,深化對微生物電子轉移機制的理解。
<strike id="yiuck"></strike>
<strike id="yiuck"></strike>