熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Low yield and abiotic origin of N2O formed by the complete nitrifier Nitrospira inopinata
由完全硝化劑 Nitrospira inopinata 形成的 N2O 的低產和非生物來源
來源:Nature Communications(2019年,第10卷)
論文總結
研究通過綜合運用微生物生理學、基因組學和同位素技術,探究了完全氨氧化細菌(comammox)Nitrospira inopinata 產生一氧化氮(NO)和氧化亞氮(N2O)的能力、途徑及產量,并與傳統氨氧化細菌(AOB)和古菌(AOA)進行了比較。以下是對論文的詳細總結。
摘要概括
摘要指出,N2O是一種重要的溫室氣體,微生物硝化作用是其主要來源之一。傳統認為氨氧化細菌(AOB)和古菌(AOA)是N2O的主要生產者,但新發現的完全氨氧化細菌(comammox)的貢獻未知。本研究以純培養的comammox細菌N. inopinata為對象,發現其對NO清除劑敏感、不能反硝化產生N2O,且N2O產量與AOA相當但遠低于AOB。進一步證明其N2O源于羥胺(NH2OH)的非生物轉化,且產量不受氧氣濃度影響。基因組分析表明comammox缺乏NO還原酶(nor基因),無法進行硝化菌反硝化。結果表明comammox在硝化過程中可能比AOB產生更少的N2O,對全球N2O排放的貢獻較小。
研究目的
本研究旨在解決以下核心問題:
評估comammox細菌N. inopinata產生NO和N2O的能力及產量。
闡明其NO和N2O產生的途徑(生物 vs. 非生物)。
通過比較基因組學分析comammox的氮代謝基因庫存,揭示其與AOB/AOA的差異。
量化不同氧氣條件下N2O的產量,評估環境因素對其排放的影響。
研究思路
研究采用多學科方法:
比較基因組學:分析N. inopinata及23個comammox宏基因組組裝基因組(MAGs)的氮代謝關鍵基因(如nirK、nor、cytL等),與AOB/AOA對比(Fig. 2)。

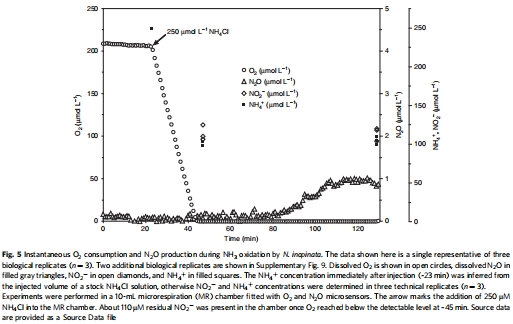
微呼吸測量:使用丹麥Unisense微電極系統實時監測O2、NO和N2O的瞬時動力學,探究NH3和NO2?氧化過程中的氣體產生與消耗(Fig. 3, 4, 5)。


抑制劑實驗:應用NO清除劑PTIO抑制N. inopinata活性,驗證NO在代謝中的關鍵作用。
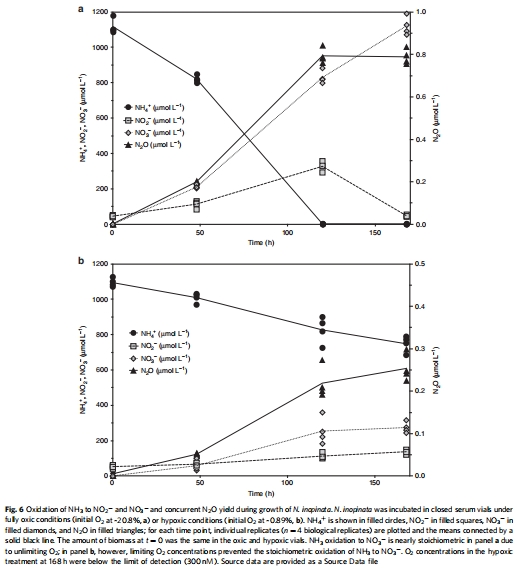
批量培養與氣體測量:通過氣相色譜(GC)定量N2O產量,計算N2O/NH3比值,評估缺氧與富氧條件下的差異(Fig. 6)。
同位素分析:測定N2O的位點偏好(δ15N-SP),區分生物與非生物來源。
非生物控制實驗:驗證熱死細胞及培養基組分對N2O產生的貢獻。
測量數據及其研究意義
以下列出關鍵測量數據、其來源(圖編號)及研究意義:
基因組庫存數據(來源:Fig. 2)
數據:所有comammox基因組(包括N. inopinata)均編碼nirK(亞硝酸鹽還原酶),但完全缺乏norCBQD和norSY(NO還原酶)基因;cytL(P460細胞色素)基因零星分布。
研究意義:遺傳證據表明comammox無法通過硝化菌反硝化途徑還原NO至N2O,與AOB形成鮮明對比;nirK存在提示其可能產生NO。
微呼吸動力學數據(來源:Fig. 3, 4)
數據:NH3氧化時,NO快速升至峰值(~13 nM)后消耗;NO2?氧化時,NO穩定在~45 nM;缺氧時無NO釋放。O2消耗與NO產生耦合。
研究意義:證明NO是代謝中間體,但產生量低(較AOB低10倍);缺氧無NO表明無厭氧呼吸能力;支持NO可能通過未知NO氧化酶(NOO)再氧化。
PTIO抑制數據(來源:Supplementary Fig. 5)
數據:PTIO對N. inopinata的EC50為18.9 μM(微呼吸)和63.6 μM(批量培養),接近AOA(17.5-18.3 μM)但遠低于AOB(>300 μM);抑制可逆(低濃度時)。
研究意義:NO清除抑制活性,證實NO是代謝關鍵中間體;comammox對PTIO敏感性與AOA相似,提示調控機制類似。
N2O產量與同位素數據(來源:Fig. 5, 6)
數據:富氧下N2O產量為0.070±0.006%(N2O/NH3);缺氧下為0.073±0.033%,無顯著差異;δ15N-SP為33.4±0.3‰(富氧)和34.2±1.4‰(缺氧),與NH2OH非生物轉化一致(30.8-35.6‰)。
研究意義:N2O產量低且與AOA相當(0.07-0.09%);產量不隨氧氣變化,與AOB相反(缺氧時增高);同位素證據支持非生物起源(NH2OH與NO2?反應)。
非生物控制數據(方法部分)
數據:熱死細胞+NH2OH/NO2?產生0.83±0.1 μM N2O,與活細胞延遲釋放的N2O量吻合。
研究意義:直接證明N2O源于胞外NH2OH的化學分解,而非酶促反應;排除生物反硝化貢獻。
研究結論
本研究得出以下核心結論:
Comammox的N2O產量低:N. inopinata的N2O產量(0.07%)與AOA相當,遠低于AOB(0.095-0.27%),表明其在環境中可能不是主要N2O源。
非生物起源主導:N2O主要來自NH2OH與NO2?的化學反應,而非酶促反硝化;同位素簽名(高δ15N-SP)和缺氧無增量支持此機制。
遺傳缺陷致無反硝化能力:comammox缺乏nor基因,無法進行硝化菌反硝化,與AOB根本不同。
NO為關鍵中間體但嚴格調控:NO由HAO或NirK產生,但產量低且缺氧不積累,提示存在高效NO氧化或消耗途徑。
生態意義:Comammox在低氮環境中可能降低N2O排放,但需野外研究驗證;PTIO不能選擇性抑制AOA(comammox同樣敏感)。
丹麥Unisense電極測量數據的詳細解讀
在本研究中,丹麥Unisense微電極系統(型號OX-MR、N2O-MR和ami700-NO)用于實時監測微生物呼吸和氣體動力學,其研究意義主要體現在:
高分辨率實時監測:Unisense電極提供nM級檢測限(NO檢測限0.25 nM),允許在毫升級反應室中連續追蹤O2、NO和N2O的瞬時變化(如Fig. 3-5)。例如,Fig. 3顯示NO峰值在O2消耗30%時出現,直接證明NO產生與好氧氨氧化耦合。
揭示代謝動態:電極數據捕捉到NO產生與消耗的快速轉換(如Fig. 3中NO峰后下降),提示N. inopinata存在NO氧化機制;而缺氧無NO釋放(對比AOB)證明其無厭氧反硝化能力。
定量動力學參數:通過測量底物添加后的氣體通量,計算表觀速率(如O2消耗率)、親和力(Km)和閾值,為模型提供參數(如Fig. 4中NO2?氧化時NO穩態~45 nM)。
驗證遺傳假設:電極數據與基因組結果一致——無nor基因導致無N2O積累(Fig. 5中N2O傳感器無信號);PTIO抑制實驗進一步確認NO的代謝中心角色。
技術優勢:Unisense系統的微尺度測量(10 mL反應室)避免頭空間干擾,提供原位溶解氣體濃度;多傳感器同步監測(O2、NO、N2O)確保數據一致性。
生態推論:低NO產量(nM級)和N2O缺乏表明comammox在自然環境中可能不貢獻顯著N2O,電極數據為降低排放的策略提供依據。
總之,丹麥Unisense電極數據是本研究的實驗核心,通過提供高精度、實時的氣體動力學測量,它直接驗證了comammox的代謝特性(低NO產量、無N2O酶促產生)、揭示了非生物N2O起源,并支撐了其與AOB/AOA的功能差異。這項技術突出了微呼吸測量在微生物生理學研究中的關鍵作用,為理解氮循環微生物的排放貢獻提供了可靠方法。
<strike id="yiuck"></strike>
<strike id="yiuck"></strike>